Corrosie en de bestrijding ervan
Corrosie komt in de praktijk in verschillende vormen voor. Iedere corrosievorm vraagt de nodige aandacht van de constructeur en procestechnoloog met het oog op corrosiepreventie. Het ontstaan en het voorkomen van corrosiemechanismen hangen dan ook nauw met elkaar samen. Onwetendheid heeft in de praktijk al tot zeer veel onnodige schade geleid. Feitelijk kan gesteld worden dat de meeste corrosie voorkomen had kunnen worden, mits er voldoende kennis aanwezig was geweest. De wens is dan ook dat dit artikel bij zal dragen om corrosie verder terug te dringen.
Door Ko Buijs - Innomet Consultancy BV - (Dit artikel is ook als PDF te downloaden door hier te klikken)
Apparaten en installaties hebben een technische- en economische levensduur. Voor zover de technische levensduur doorslaggevend is, bemerkt men veelal dat het fenomeen corrosie de grote spelbreker is die de uiteindelijke levensduur bepaald. Daarom worden er in ons land jaarlijks voor honderden miljoenen Euro’s aan apparaten en installaties vernieuwd omdat de corrosie aan de bestaande uitrustingen het technisch functioneren van het geheel teveel had aangetast. Marketingtechnisch gezien heeft het vervangen van systemen uiteraard ook bepaalde voordelen doch het streven zal altijd blijven de technische levensduur zolang mogelijk te houden. Ook is het dan weer relevant om niet ‘over te ontwerpen’ want dan bereikt men weer dat de technische levensduur de economische overschrijdt, wat op zich weer niet nodig is. Het apparaat moet toch immers vervangen worden teneinde het rendement te halen wat voor ogen is gesteld. Met onderstaand artikel is gestreefd een bijdrage te leveren om uiteindelijk tot een optimale keuze te komen t.a.v. de materiaalkeuze en procesbeheersing.
Definitie corrosie
Een veel gebruikte definitie voor corrosie is een ongewenste aantasting van een metaal ten gevolge van chemische- of elektrochemische reacties aan het metaaloppervlak door componenten die in de nabije omgeving aanwezig zijn. Corrosie is een chemische reactie die spontaan zal verlopen indien de thermodynamische conditie hiervoor aanleiding geeft. De snelheid waarmee zo'n reactie zal plaatsvinden is medebepalend voor het uiteindelijke gebruik van een bepaald metaal. Corrosie kent meestal twee deelreacties t.w. de anodische en de kathodische reactie. Stopt een van deze reacties dan stopt de andere ook. Dit is op zich al een wetmatigheid dat corrosie effectief de kop in kan drukken. Als de kathodische reactie versneld dan verloopt de anodische reactie ook sneller. Later in dit artikel wordt nog nader stil gestaan bij deze scheikundige reacties.
Corrosievormen
Onderstaand wordt in het kort verschillende typen corrosie omschreven. Omdat het korte beschrijvingen zijn, zal het verder duidelijk zijn dat er veel meer over mede te delen valt.
Algemene of gelijkmatige aantasting
Deze vorm van corrosie is de minst gevaarlijke omdat het aantastingsbeeld zich uitspreidt over het gehele oppervlak van een metalen voorwerp. De mate van aantasting is vrij gemakkelijk te bepalen door bijvoorbeeld het gewichtsverlies per tijdseenheid of per oppervlakte-eenheid uit te drukken (bijvoorbeeld N/m2/uur) of een dikteafname per tijdseenheid zoals mm/jaar. Deze laatste maat is de meest gebruikte aanduiding in de praktijk. Op deze wijze kan men bepalen hoeveel corrosietoeslag gegeven moet worden aan een bepaald onderdeel teneinde een gewenste levensduur te verkrijgen.
Galvanische corrosie
Deze vorm van corrosie, die ook wel contactcorrosie wordt genoemd, is een gevolg van een elektrisch geleidende verbinding van twee verschillende metalen die in aanraking zijn gekomen met een agressief milieu. Het minst edele metaal zal in dit geval veel sneller worden aangetast dan wanneer het alleen in aanraking met dit milieu was geweest. Het metaal wat in oplossing gaat, is de anode van het galvanisch element. Zelfs in één metaal kan men een vorm van deze corrosie krijgen door bijvoorbeeld een potentiaalverschil dat optreedt door samenstellingsverschillen van het metaal of milieu. In zo'n geval spreekt men van lokaalelementcorrosie.
Spleetcorrosie
Spleetcorrosie treedt alleen op in nauwe spleten vanwege een potentiaalverschil dat optreedt door het relatief lage zuurstofgehalte in de spleet. Hierdoor treedt een sterke verzuring ter plaatse op waardoor agressieve zuren ontstaan die het metaal aantasten. Deze vorm van corrosie is zeer gevreesd omdat deze zich zo verborgen afspeelt. Zelfs kan het al optreden in spleten die niet groter zijn dan 0,03 mm. Een voorbeeld is een nauw aanliggende pakking op een metalen flens. Het zal verder duidelijk zijn dat de oplossende elektrode in dit geval de metaalspleet is. Dat wordt dan per definitie de anode genoemd.
Zwerfstroomcorrosie
Indien een metalen leiding, die zich in de grond bevindt, in de buurt ligt van een stroom voerend net, kan een gedeelte van die stroom via de bodem en de leiding terugvloeien naar het net. Op die plaats waar de stroom uit de leiding treedt, zal corrosie optreden. Dergelijke corrosie komt nog wel eens voor bij treinrails die in een elektrisch circuit zijn opgenomen.
Korrelgrenscorrosie
Korrelgrenscorrosie, ook wel interkristallijne corrosie genoemd, is gevolg van een potentiaalverschil tussen de grenzen van de metaalkristallen en de kristallen zelf. Corrosietoeslag heeft hier dus nauwelijks zin. Als maat wordt gebruikt de penetratie per tijdseenheid. De corrosiesnelheid is over het algemeen hoog te noemen. Het grote gevaar van deze vorm van corrosie is dat door het aantasten van de korrelgrenzen het onderlinge verband van de kristallen verloren gaat waardoor de kristallen op den duur los komen te liggen. De drie hoofdoorzaken dat de grenzen gevoelig worden voor deze aantasting zijn:
- Uitscheiding van legeringselementen die bij een bepaalde oververzadiging en een langzame afkoeling zich kunnen uitscheiden op de korrelgrenzen. Een voorbeeld is de vorming van chroomcarbiden in roestvaststaal die zich op de korrelgrenzen nestelen vanwege de dislocaties c.q. roosterfouten die zich in de zones bevinden. Het grote gevaar van dit fenomeen is dat er hierdoor zoveel chroom uit de matrix kan worden onttrokken waardoor er lokaal onvoldoende chroom aanwezig is om het roestvaststaal op die plaatsen passief te houden.
- Twee naast elkaar liggende kristallen kunnen door hun onderlinge posities dislocaties bewerkstelligen wat een gemakkelijke aanleiding is voor het uittreden van metaalionen op die plaats.
- Als kristallen zich gaan vormen worden onzuiverheden voor het stollingsfront uitgedreven en zullen zich uiteindelijk nestelen op de korrelgrenzen. Dit fenomeen wordt ook wel segregatie genoemd. Dergelijke onzuiverheden reageren vrijwel altijd anodisch in een chemisch milieu, waardoor de aantasting van de korrelgrenzen een feit is.
Hoge temperatuur corrosie
Deze corrosievorm wordt ook wel oxidatie genoemd omdat het een kwestie is van het reageren met zuurstof bij verhoogde temperatuur. In dit geval speelt vocht geen enkele rol. Op deze wijze ontstaan er oxideschillen op het metaal die een andere uitzettingscoëfficiënt bezitten dan het moedermateriaal waardoor bij mechanische spanningen (door bijvoorbeeld grote temperatuurverschillen) zo'n schil bros wordt of afbreekt van de grondlaag. Door het juist legeren van zo'n metaal met bepaalde elementen kan men de oxidatievastheid enorm vergroten. Bij roestvast staal maakt men dan graag gebruik van de elementen aluminium en/of silicium die de oxidehuid aanmerkelijk doen versterken.
Biologische corrosie
Indien micro-organismen afsterven dan is er zuurstof nodig om dergelijke organische stoffen om te zetten in kool- en waterstof. Zodoende ontstaan er verschillen in zuurstofgehalte waardoor er biologische corrosie kan ontstaan. Daarom is het zo belangrijk dat bacteriën zich niet kunnen afzetten in dode hoeken van systemen omdat op dergelijke locaties dit soort corrosie kan optreden. Regelmatig reinigen van dergelijke constructies is dan ook een noodzaak. Soms wordt biologische corrosie door het metaal zelf bestreden indien er ionen ontstaan die de groei van dergelijke organismen remmen zoals bijvoorbeeld bij koperionen. Koper is dan ook een element met een biocidale werking. Een bekende variant hiervan is microbieel geïnduceerde corrosie (MIC) dat vooral optreedt in leidingen, sprinklersystemen, koelunits en proceswaterinstallaties. Er ontstaat dan een biofilm waarin schadelijke bacteriën zich kunnen afzetten. Niet alleen kunnen de producten hierdoor geïnfecteerd worden, maar ook zal een biofilm de warmteoverdracht nadelig beïnvloeden. Zelfs kunnen deze organismen gehele systemen dicht laten slibben door de vorming van zogenaamde tuberkels. Bovendien veroorzaken zij ernstige corrosie. Sprinklerinstallaties kunnen daardoor nagenoeg geheel verstopt raken en dat is een zeer ongewenste situatie in het geval van brand. Een voorbeeld van bacteriën, die gemakkelijk corrosie initiëren, zijn sulfaat reducerende bacteriën (SRB’s) die zich als een slijmerige biofilm hechten op het oppervlak en uiteindelijk sulfaat omzetten in zwavelzuur. Ook kan MIC ontstaan door kathodische depolarisatie. Dan betreffen bacteriën die waterstof nodig hebben om zich te vermenigvuldigen. Deze waterstof onttrekken ze aan de kathodische deelreactie die dan sneller gaat verlopen. Dit zorgt er dan weer voor dat de anodische deelreactie wordt versneld waardoor er meer aantasting van het metaal komt.
Putvormige corrosie
Deze corrosie kenmerkt zich door het lokale karakter. De verschijnselen zijn dan ook putvormige aantastingen (pitting) die zich in het algemeen vrij snel en diep vormen. De hoofdoorzaak is veelal een plaatselijke beschadiging van de passieve oxidehuid, waardoor een agressief milieu op die plaatsen een verwoestend werk kunnen doen. Ook imperfecties in een dergelijke huid of ongewenste inbeddingen van andere metaaldeeltjes in het oppervlak, kunnen een oorzaak zijn tot putvormige corrosie. In dit verband kan men denken aan stalen slijpdeeltjes die zich in een roestvast staal oppervlakte binnendringen. Dit wordt ook wel contaminatie genoemd. Ook een belangrijke oorzaak is de penetratie van specifieke componenten uit een milieu zoals halogeenionen. Een goed voorbeeld hiervan zijn de chloriden. Daarom is naast de pH waarde en het geleidend vermogen van het elektrolyt ook relevant te weten hoe groot het percentage chloor-ionen is. Overige oorzaken zijn zwerfstromen en stromingsverschillen die veelal door turbulentie ontstaan, waardoor er verschillen ontstaan in het zuurstofgehalte.
Spanningscorrosie
Een combinatie van mechanische spanning en een corrosief milieu bewerkt een versnelde corrosie op die plaatsen waar de spanning het hoogste is. Hierdoor treedt relatief snel scheurvorming op terwijl het materiaal in de buurt nog volkomen gezond is. Soms lopen de scheuren langs de korrelgrenzen (interkristallijn) en maar meestal lopen deze dwars door de korrels heen (transkristallijn). Deze scheurvorming ontstaat in afhankelijkheid van het soort metaal en het blootgestelde milieu. Spanningscorrosie treedt vooral op zodra er chloriden in combinatie met mechanische spanningen aanwezig zijn en dat bij temperaturen boven 40oC. In een waterig milieu ontstaat bij de kathode waterstofgas dat via scheurtjes en kerfjes ook het materiaal binnen kan dringen. Dat wordt ook wel diffusie genoemd. Op die plaatsen kan er dan waterstofverbrossing ontstaan. Het onderste punt van de kerf wordt dan ook brosser waardoor een bestaand scheurtje of kerfje gemakkelijk en zeer snel verder kan scheuren. De reden dat de corrosie zich zo hevig focusseert op een spanningsgebied kan verklaard worden door het feit dat ten gevolge van de mechanische spanning microscheurtjes in de oppervlaktehuid kunnen komen waardoor er een potentiaalverschil komt tussen de geoxideerde huid en het blanke metaal in de scheurtjes. Op deze wijze staat een relatief klein actief breukoppervlak tegenover een groot passief glad oppervlak. Bovendien krijgt men door de kerfwerking in de scheurtjes plaatselijk zeer hoge spanningen in het metaal waardoor de scheurvorming met rasse schreden zich kan voortplanten wat uiteindelijk een snelle breuk tot gevolg heeft.
Vermoeiingscorrosie
Het woord zegt het al want hier is een combinatie van metaalmoeheid t.g.v. een langaanhoudende wisselende mechanische spanning en de aanwezigheid van een corrosief milieu, aanleiding tot versnelde corrosie op die plaatsen die als anode fungeren.
Erosie/corrosie
Deze combinatie, die ook wel cavitatie-corrosie wordt genoemd, leidt ook tot versnelde corrosie die veelal een algemene aantasting betreft. De hoofdoorzaak is veelal dat de passieve metaaloxidehuid weggesleten wordt door een abrasief middel en dat het metaal hierdoor geen of te weinig kans krijgt om zich opnieuw te passiveren waardoor het weer versneld corrodeert.
Theorie over corrosie
Metalen worden op enkele uitzonderingen na, gedolven in de natuur als metaalertsen. In de allermeeste gevallen betekent dit dat een metaal wordt gevonden als een verbinding met andere elementen. Dit houdt in dat dit thermodynamisch gezien een evenwichtstoestand is. Dat betekent dat deze materie zich bevindt in de laagste energie toestand, waar ieder systeem nu eenmaal naar streeft. Dat zijn nu eenmaal natuurwetten. Wordt een reductiemiddel toegevoegd plus energie, dan kan men zo'n metaal vrij gemaakt worden uit zijn erts. Een bekend voorbeeld is de ijzerbereiding in een hoogoven m.b.v. cokes als reductiemiddel en energie die men toevoegt. Indien een hypothetisch metaal Me wordt gereduceerd met koolstof dan geschiedt in principe de volgende reactie:
2MeO + C + energie → 2Me + CO2.
Een dergelijke reactie wordt ook wel een endotherme reactie genoemd omdat er warmte nodig is om deze reactie te kunnen laten plaatsvinden. Op deze wijze wordt het metaal naar een hogere energietoestand gebracht wat op zich dus geen evenwichtstoestand is. M.a.w. ziet het metaal weer kans deze energie kwijt te raken dan gebeurt dat spontaan onder afgifte van warmte. Dat wordt een exotherme reactie genoemd. Dit proces noemt men ook wel corroderen of oxideren wat feitelijk het verbranden van een metaal is. Dit corrosieproces verloopt sneller naarmate het metaal minder edel is. De corrosieproducten die daarbij ontstaan, zijn qua samenstelling uiteraard afhankelijk van het soort milieu waarin dat corroderen heeft plaats gevonden.
De vraag is nu wat er nu eigenlijk gebeurt tijdens het corroderen. De volgende reactie vindt dan plaats met het hypothetische metaal Me. Die luidt dan:
2Me + O2 → 2MeO.
Deze reactie is dus de oxidatie van een metaal of anders gezegd, het metaal verbindt zich met het element zuurstof. Feitelijk is dat de vorm waarin het metaal als erts is gevonden.
De deelreacties die zich aan corrosie ten grondslag liggen zijn als volgt:
- Me → Me2+ + 2e-
- O2 → 2O
- +2e- → O2-
- Na het samenstellen leidt dit tot de totale reactie: 2Me + O2 → 2MeO
- De eigenlijke oxidatiereactie is dus Me → Me2+ + 2e-
In principe maakt het niets uit of deze oxidatie heeft plaatsgevonden m.b.v. zuurstof of een ander oxidatiemiddel. In principe bewerkt een dergelijke reactie dat een metaal is overgegaan in een positief ion en een bepaalde oplossing. De vrije elektronen worden in de regel direct in het systeem overgedragen.
Als een metalen staaf in een oplossing van zijn eigen ionen wordt geplaatst dan treedt de volgende evenwichtsreactie op:
Me → Me2+ + 2e-
Indien de reactie naar links verloopt, wordt het metaal positief geladen t.o.v. de oplossing en het wordt negatief geladen als de reactie naar rechts verloopt. Het opbouwen van dit potentiaalverschil gaat het verder verlopen van de reactie verhinderen, tenzij een tweede reactie, die tegelijkertijd optreedt, dit potentiaalverschil weer weg kan werken.
Bijvoorbeeld:
- Zn → Zn2+ + 2e- oxidatie reactie
- 2H+ + 2e → H2 reductie reactie
- Zn + 2H+ → Zn2+ + H2
Deze reactie blijft verlopen en de zinkstaaf corrodeert weg. Het optreden van reductiereactie is essentieel voor het optreden van corrosie. Het tegengaan van deze corrosie kan bereikt worden door:
- Wegnemen van het elektrolyt of wel het verwijderen van het agressieve milieu.
- De zinkstaaf bedekken met een coating zoals een verflaag.
- De potentiaal van de zinkstaaf kunstmatig verlagen m.b.v. een uitwendige spanningsbron waardoor de oxidatie-reactie niet meer kan verlopen.
Indien een koperen staaf in een koperoplossing (Cu2+) wordt geplaatst en een zinkstaaf in een zinkoplossing (Zn2+) en deze twee oplossingen van elkaar scheiden door een diafragma dat geen metaalionen doch wel elektronen doorlaat, dan zullen beide staven een potentiaal aannemen t.o.v. de oplossing en wel onafhankelijk van elkaar. Het spanningsverschil dat we kunnen meten blijkt 1,1 Volt te zijn waarbij het halfedele koper positief is t.o.v. het onedele zink. Nadat we beide staven elektrisch hebben verbonden, zal er een stroom gaan lopen van Cu naar Zn (afbeelding 1). Aan de koperen electrode vindt reductie plaats van Cu2+ ionen. Per definitie wordt de elektrode waar de reductie plaats vindt de kathode genoemd. Aan de zinkstaaf wordt zink geoxideerd tot Zn2+. Per definitie wordt de elektrode waar oxidatie plaatsvindt de anode genoemd.
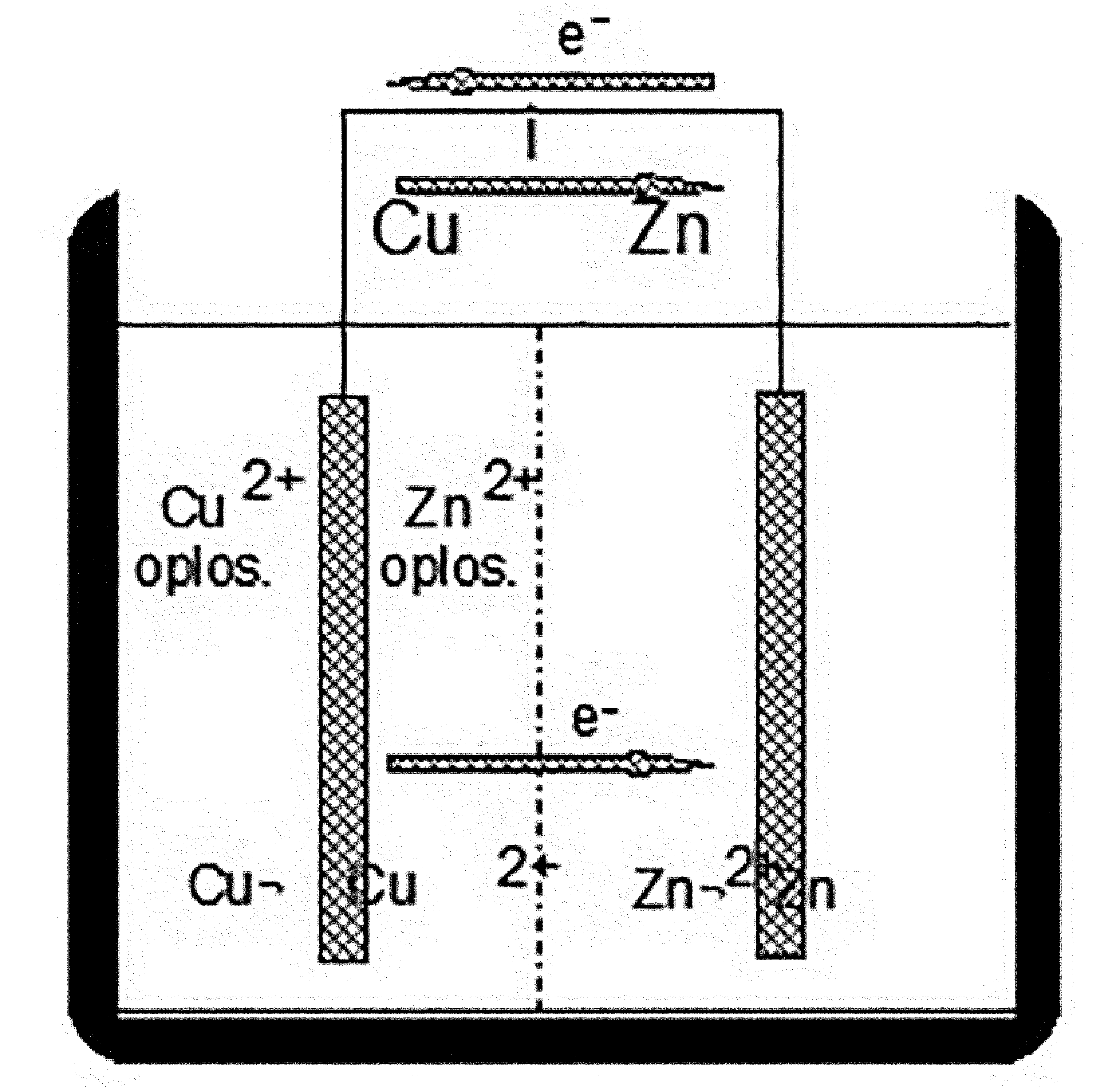
Afbeelding 1
Bij de geschetste opstelling in afbeelding 1 gaat dus de zinkstaaf in oplossing en dat is op drie manieren tegen te gaan, namelijk:
- De zinkstaaf isoleren door een coating aan te brengen.
- De verbindingsdraad verbreken.
- Door het wegnemen van de Cu2+ ionen. Hierdoor stopt de kathodische reactie en daarmee gelijktijdig de anodische reactie.
De geschetste opstelling is een voorbeeld van galvanische corrosie. Bovenstaande remedies om de galvanische corrosie te stoppen worden later in dit artikel nog nader beschouwd. De uitleg beoogt echter meer duidelijkheid te verschaffen van het corrosiemechanisme in zijn algemeenheid.
De potentiaal
Onder het begrip potentiaal wordt begrepen de elektrische spanning in Volt, die een metaal aanneemt wanneer het in een vloeistof wordt gedompeld. Deze spanning wordt veroorzaakt door de hoeveelheid metaalionen die in oplossing gaat en de daarmee equivalente hoeveelheid elektronen die per oppervlakte-eenheid van het metaal aanwezig zijn. De grootte van de spanning wordt bepaald door de edelheid van een metaal of m.a.w. hoeveel metaalionen er in oplossing gaan. Des te meer ionen in oplossing gaan, des te onedeler het metaal is. Bij bijvoorbeeld platina en goud gaan er geen ionen in oplossing, bij halfedele metalen zoals koper en nikkel relatief weinig en bij onedele metalen zoals bij zink en magnesium gaan er veel tot zeer veel metaalionen in oplossing. Zo ontstaat er een edelheidsreeks die in een reeks uitgezet kan gaan worden.
Afbeelding 2: Voorbeeld van een corrosie element.
Beschouwt men een corrosie-element zoals in afbeelding 2 is te zien, dan kan men spreken over een potentiaal van de anode en van de kathode ten opzichte van de aanwezige vloeistof. De elektromotorische kracht (EMK) van het corrosie-element is het verschil van deze twee potentialen. Het is echter niet mogelijk het potentiaalverschil tussen de elektrode en de vloeistof waarin deze gedompeld is, te meten en daarom is er een referentie-elektrode gedefinieerd. In de praktijk werkt men dan ook veelal met de waterstofelektrode die arbitrair de potentiaal 0 heeft gekregen. Men kan zo altijd het potentiaalverschil meten zowel van de anode als de kathode ten opzichte van de waterstofelektrode. Ook is er m.b.v. de thermodynamica een formule ontwikkeld teneinde al deze potentiaalverschillen te berekenen. Deze waarden zijn in tabel 1 afgebeeld en wordt de elektrochemische spanningsreeks genoemd.
|
K+ -2,92 Na+ -2,75 Mg++ -3,24 Al+++ -1,67 Zn++ -0,76 Cr++ -0,71 Fe++ -0,44 Cd++ -0,40
|
Ni++ -0,25 Sn++ -0,135 Pb++ -0,125 H+ 0,000 Cu++ +0,345 Hg++ +0,80 Ag+ +0,80 Pt++ circa +1,2 Au+++ +1,42 |
tabel 1: De elektrochemische spanningsreeks in Volt.
De reeks toont de graad van edelheid van verschillende metalen aan. Natrium en kalium zijn dus zeer onedel en gaan dus gemakkelijk in oplossing. In water kan natrium spontaan ontvlammen. Goud en platina reageren niet of zeer moeilijk vanwege het zeer edele karakter. Naarmate de normaalpotentiaal daalt, wordt dus het metaal onedeler. Ook is het een feit dat twee verschillende metalen die met elkaar elektrisch in contact zijn gebracht, in een elektrolyt zich dusdanig ten opzichte van elkaar zullen gedragen, dat het minst edele metaal in oplossing gaat. Het edele metaal wordt derhalve beschermd door de minder edele totdat laatstgenoemde geheel is opgelost. Een voorbeeld zijn de zinkanodes op een stalen schip, die van tijd tot tijd vernieuwd moeten worden. Deze vorm van corrosiebescherming wordt ook wel kathodisch beschermen genoemd. Bovenstaand mechanisme kan men ook 'vertalen' naar slechts één enkel metaal. Op een oppervlak van een metaal kunnen allemaal zeer kleine lokaalelementen aanwezig zijn door allerlei oorzaken zoals structuurverschillen (bijvoorbeeld alfa en béta kristallen), spanningsverschillen en variaties in het milieu. Zo kan m.b.v. een elektrolyt het kleine anodische plekje in oplossing laten gaan ten gunste van de kathodische plekjes, waardoor er lokale corrosie ontstaat. Op den duur echter komen de kathodische plekjes los te liggen waardoor deze verdwijnen en op deze wijze komen nieuwe anodische plekjes in contact met het milieu (afbeelding 3). Zo schrijdt het corrosieproces zich voort en is een algemene aantasting een feit.
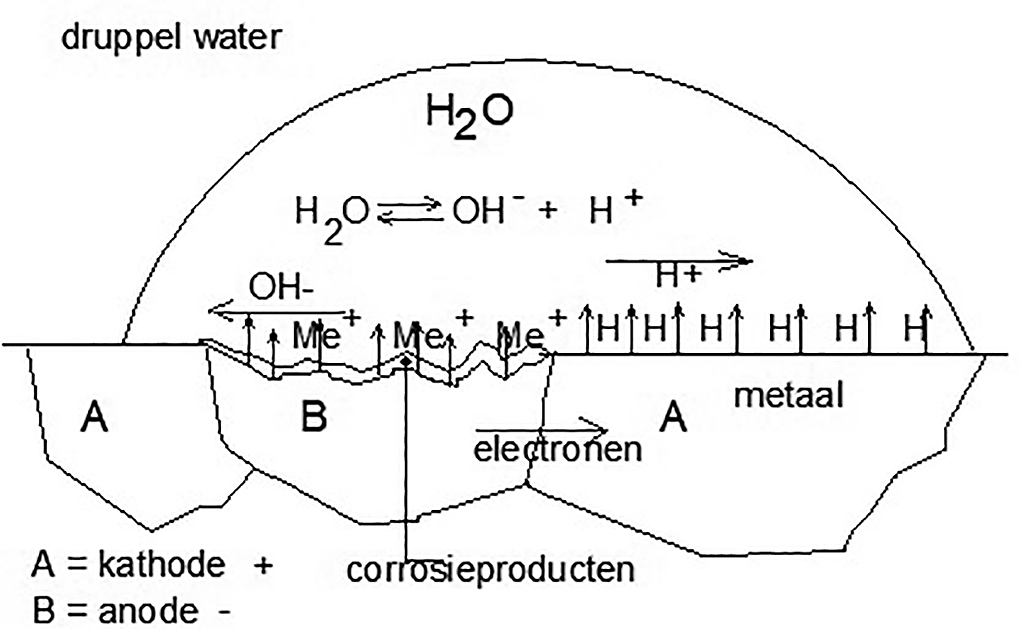
Afbeelding 3: Schematische voorstelling van een lokaal corrosie-element onder een druppel.
Hoewel er zeer veel te schrijven is over de diverse corrosiemechanismen, beperken we ons in dit artikel tot bovenstaande beknopte uiteenzetting. De praktische vraag hoe men corrosie moet tegengaan is vaker meer relevant. Naast allerlei mechanismen om corrosie tegen te gaan, is het ook zeer belangrijk welke materiaalkeuze men doet en hoe de constructie is opgebouwd. In de praktijk wordt vaak de lat onnodig hoog gelegd en neemt men onnodig dure metalen, terwijl de oplossing beter gezocht had kunnen worden met een geheel andere constructie of opstelling van het systeem. Ook blijft uiteraard de materiaalkeuze van groot belang en daarom is een samenspraak tussen een metaalkundige, de constructeur, de procestechnoloog, de aannemer en de gebruiker noodzakelijk om een optimale materiaalkeuze te bewerkstelligen. Ook kan het advies van een procestechnoloog van belang zijn omdat bijvoorbeeld de wijziging van de zuurgraad (pH) of een verlaging van de temperatuur van de corrosieve belasting ook een bepalende factor is.
Corrosiebestrijding
Het zal inmiddels duidelijk zijn dat de allermeeste corrosievormen hun wortels hebben in het verschil van lokale potentialen, waardoor de minst edele plekjes reageren met het medium. Een ander woord hiervoor is dat deze plekjes actief worden. In feite heeft ieder systeem wat weer terug wil naar zijn oude staat, een actieve potentie. Dit blijkt bijvoorbeeld met ijzer dat eenmaal in contact gekomen is met vocht c.q. elektrolyt onmiddellijk gaat reageren zodat er roestvorming ontstaat. Indien men kans ziet dit actieve gedrag te veranderen in een passief gedrag, dan is de zaak dus in feite opgelost. Een heel bekende methode is het staal legeren met minimaal 12% chroom waardoor spontaan aan de lucht een taaie hechte oxidehuid ontstaat die hetzelfde volume heeft als het moedermateriaal. Hierdoor wordt het metaal afgesloten door een huid van chroomdioxide. Het is a.h.w. ingepakt en het moedermateriaal kan niet meer reageren met de omgeving omdat de potentiaal sterk stijgt van negatief naar positief (zie afbeelding 4).
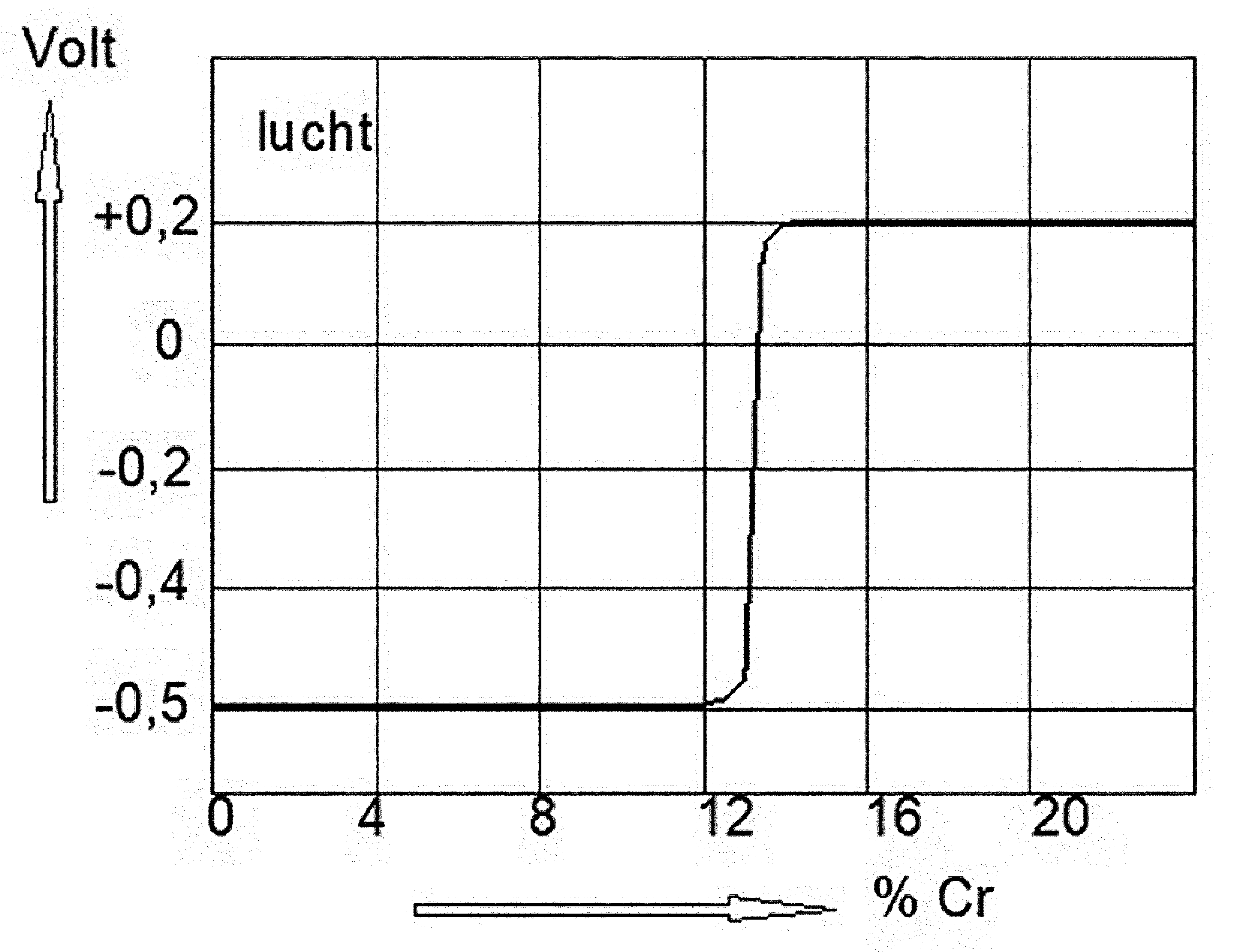
Afbeelding 4: Invloed van het chroomgehalte van een ijzerchroomlegering op de potentiaal, gemeten t.o.v. de H2-electrode in water verzadigd met lucht.
Bij beschadiging van zo'n oxidehuid wordt deze automatisch hersteld mits er zuurstof aanwezig is. Dit houdt onder meer in dat men de nodige voorzichtigheid moet betrachten in reducerende milieus. In dergelijke omstandigheden kan de drang om zuurstof op te nemen zo groot zijn dat het gebonden zuurstof zelfs 'afgepakt' kan worden van het chroom waardoor de oxidehuid afgebroken wordt en uiteraard kan deze niet hersteld worden als er geen zuurstof in de omgeving is. Dit verbreken van de chemische binding noemt men ook wel dissociëren. Dat is vooral het geval bij sterk reducerende zuren zoals zout- en zwavelzuur. Niet alleen roestvaststaal kent het mechanisme van de perfect aansluitende oxidehuid doch ook metalen zoals aluminium, titaan en zirkoon.
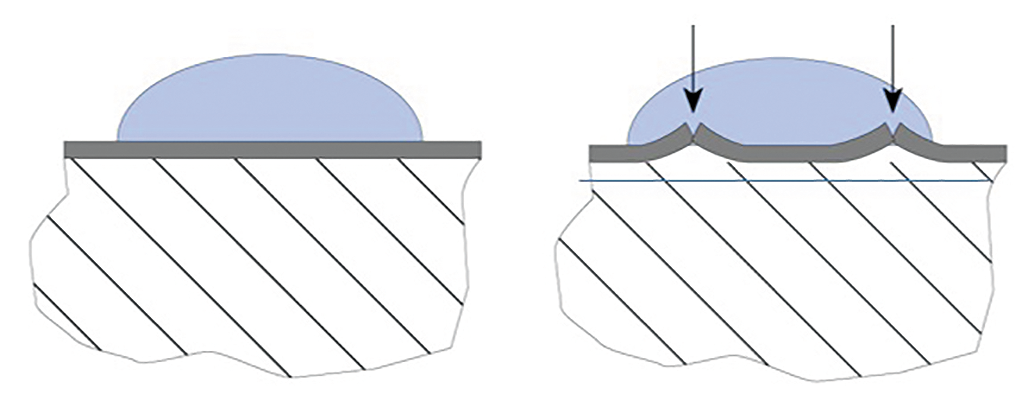
Afbeelding 5: Links een actief metaal met dichte oxidehuid; rechts laagje ijzeroxide dat door een groter volume zichzelf kapot drukt waardoor het roesten verder gaat.
Indien de oxidehuid qua volume niet past op het moedermateriaal, springt het los van de ondergrond en de oxidatie kan dan onbeperkt doorgaan zoals bijvoorbeeld het roesten van ijzer en ongelegeerd staal. Passiviteit van het oppervlak kan alleen bereikt worden indien een afgesloten geoxideerde huid op een hechte wijze aaneensluit zodat dit het actieve metaal beschermd zodat er geen kans is voor ongewenste 'binnendringers' (afbeelding 5). Ook zijn er speciale manieren om de oxidehuid te verdikken d.m.v. passiveren. Dit proces komt hierop neer dat een voorwerp, dat een gesloten oxidehuid kan opbouwen, wordt gedompeld voor een bepaalde tijd in een sterk oxiderend zuur zoals bijvoorbeeld salpeterzuur. Roestvaststaal, dat ontdaan is van zijn oxidehuid met het beitsproces, wordt veelal daarna gepassiveerd in een dergelijk zuur teneinde snel en doelmatig een dikke oxidehuid op te bouwen. Anodiseren bewerkt ook een dikkere oxidehuid. Dit proces wordt voornamelijk gedaan op aluminium componenten om deze een hogere corrosiebestendigheid te geven.
Het is ook een feit dat een passieve oxidehuid zijn beperkingen heeft bij zware corrosieve belastingen, waardoor de materiaalkeuze of het proces bijgesteld moet worden. Er zijn vele legeringen ontwikkeld op ijzer- en nikkelbasis om corrosie te weerstaan in de meeste productieprocessen. Indien dergelijke legeringen niet meer kunnen voldoen aan de gestelde eisen qua corrosiebestendigheid, dan zijn er ook metalen beschikbaar zoals titaan, zirkoon, tantaal, niobium en zelfs edele metalen zoals zilver, platina en goud.
Corrosiebestrijding m.b.v. inhibitoren
Deze methode beoogt een corrosiereactie af te remmen of zelfs geheel te verhinderen d.m.v. een 'inhibitor' die men aan het corrosieve medium toevoegt. In feite is dit een uiterst simpele methode om corrosie tegen te gaan; de zaak is echter wel om de juiste 'remstoffen' te bepalen. Empirisch is er in de praktijk heel veel bepaald zoals organische amines die de agressiviteit van zoutzuur t.o.v. staal laat afnemen. Een ander voorbeeld is het gebruik van natriumchromaat als inhibitor bij een corrosieve belasting van geconcentreerd calcium- of natriumchloride dat blootgesteld is aan staal. Het remmechanisme kan worden verklaard door adsorptie (deklaagvorming) op de anode of kathode. Daarom spreekt men in de praktijk over anodische- en kathodische inhibitoren. Ook een goed voorbeeld van een inhibitor is kopersulfaat, dat in kleine hoeveelheden toegevoegd aan verdund zwavelzuur een redelijke bescherming geeft van roestvast staal. Als alternatieve methode kan men ook enig koper legeren aan een hoogwaardig type roestvast staal waardoor er een betere bestendigheid tegen zwavelzuur wordt bereikt. Daarom worden enkele speciale corrosiebestendige roestvaste staalsoorten, die ontwikkeld zijn voor het gebruik in zwavelzuur, gelegeerd met ongeveer 3 à 4% koper. Dit koper zal dan uiteindelijk kopersulfaat vormen op het oppervlak dat een behoorlijke bescherming geeft tegen een mogelijke aantasting. Het meest bekende roestvast staaltype op dit gebied is EN 1.4539 (904L) dat 1 tot 2% koper bevat.
Kathodische bescherming
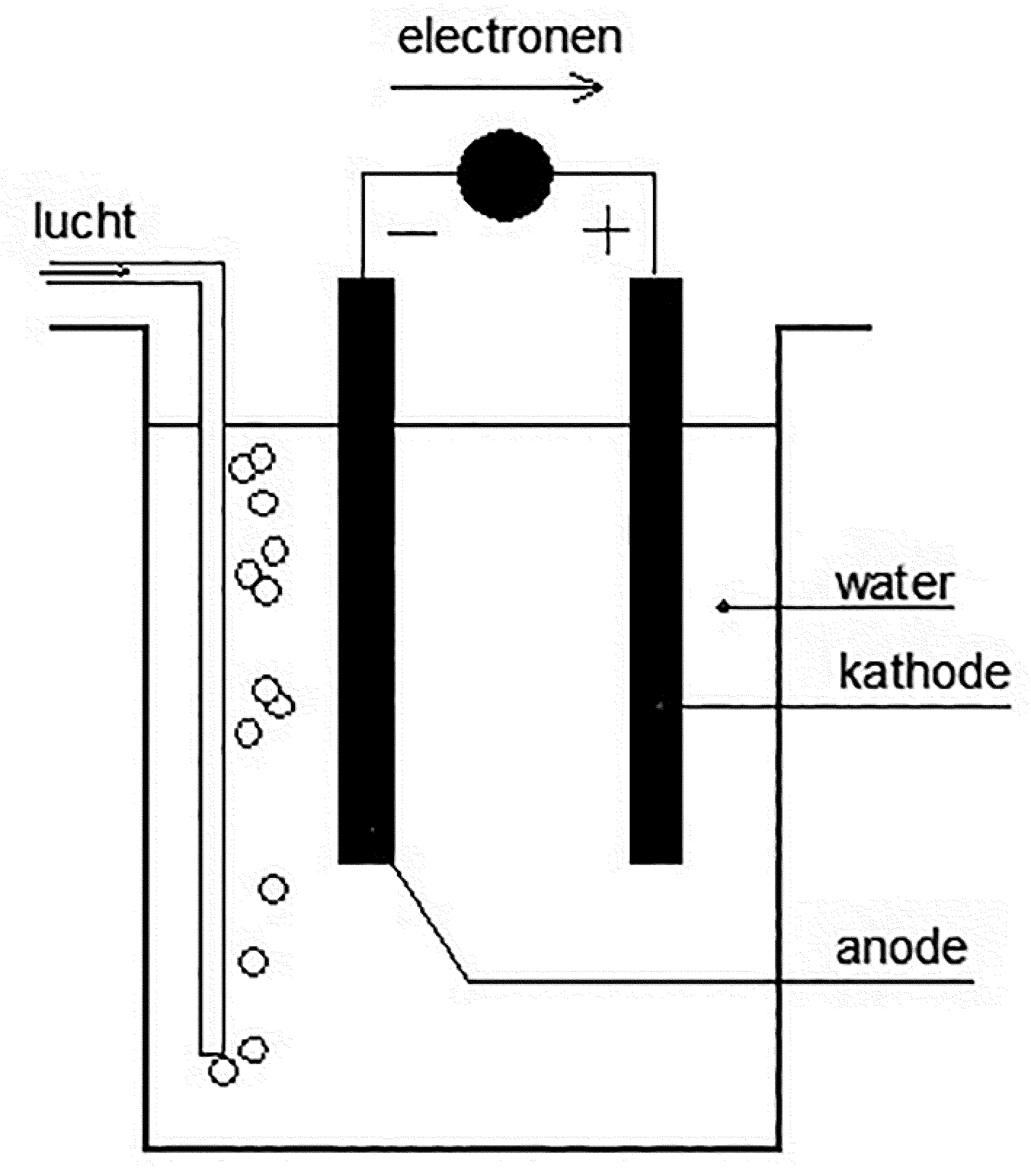
Kathodische bescherming m.b.v. een opofferingsanode, bijvoorbeeld zink bij staal, is reeds bovenstaand uitvoerig aan de orde geweest. In de praktijk blijkt echter dat het niet praktisch is om voortdurend opofferingsanoden op tijd te vervangen en daarom is er ook een manier om stroom op te drukken waardoor het vervangen van anoden in principe niet meer nodig is. In dit geval is er uiteraard wel een stroombron nodig en hulpelektrodes zoals bijvoorbeeld grafiet of geplatiniseerd titaan (zie afbeelding 6).
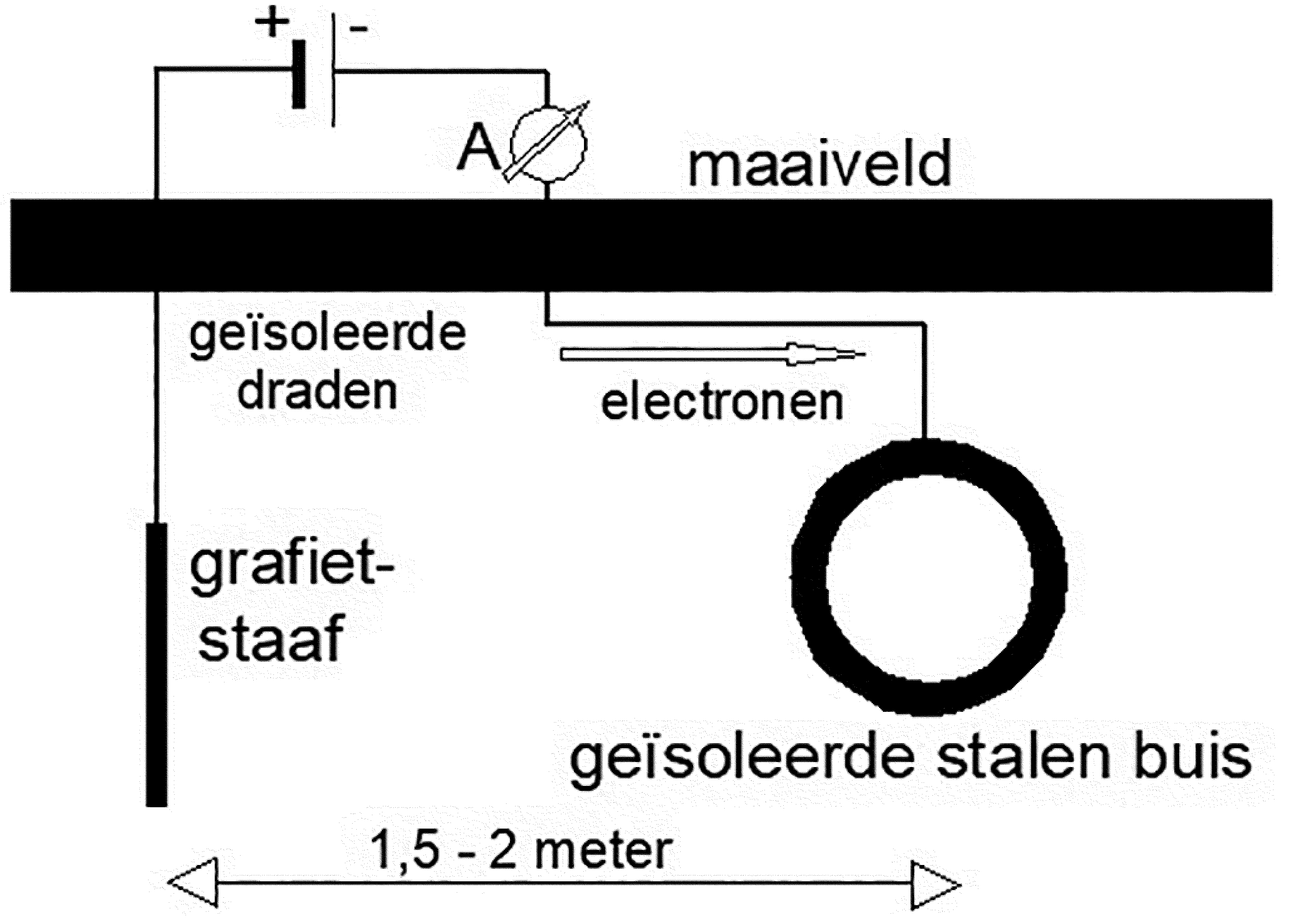
Afbeelding 6: Kathodische bescherming door het opdrukken van stroom.
In feite is het beschermingsmechanisme hetzelfde als bij het geval van de opofferingsanoden, echter de anoden gaan in principe niet of nauwelijks in oplossing. D.m.v. meetpalen kan men altijd bepalen hoeveel stroom men op het systeem moet drukken teneinde corrosie tegen te gaan. Zo kan men grote objecten beschermen tegen galvanische- en zwerfstroomcorrosie. Aan de kathode ontwikkeld zich waterstof (2H+ + 2e → 2H) in rechte evenredigheid met de hoeveelheid opgedrukte stroom. Daarom is het van belang dat men niet onbeperkt stroom opdrukt waardoor de waterstofproductie dusdanig op kan lopen, dat het de isolatie van het te beschermen object kan afdrukken. Ook legeringen die ferriet bevatten zijn dan extra gevoelig voor waterstofverbrossing. Een voorbeeld hiervan is duplex roestvast staal.
Corrosiebestrijding d.m.v. deklagen
Indien een metaal zichzelf niet passiveren kan door het vormen van een taaie afgesloten oxidehuid, kan men dit ook kunstmatig aanbrengen d.m.v. een deklaag dat ook wel een coating wordt genoemd. In de praktijk onderscheiden we diverse deklagen zoals:
- Metallische deklagen.
- Claddings.
- Verven, bitumen en plastics.
- Anodiseren.
Metallische deklagen
Voorbeelden van metallische deklagen zijn verkoperen, verchromen, verzinken, vernikkelen, vertinnen, enz. Ook met cadmium en lood kunnen deklagen aangebracht worden maar verliezen snel terrein vanwege de ongewenste milieubelasting. De meeste metalen die hierboven zijn beschreven, worden m.b.v. galvanotechniek opgebracht hoewel tin en zink ook d.m.v. het dompelen in hun vloeibare staat opgebracht kan worden. Een goed voorbeeld is het thermisch verzinken. De laagdikten zijn sterk afhankelijk van het soort proces en kunnen derhalve fluctueren tussen 4 en circa 200 µm. Dikke lagen ontstaan vooral door het thermisch aanbrengen van deklagen. Dunne lagen ontstaan vooral door het galvaniseren waar m.b.v. elektrische stroom. Op deze wijze wordt een metaal uit een oplossing van een van zijn zouten op het substraat neergeslagen. Voorts kan men ook metaalpoeders aanbrengen door spuiten van gesmolten metaalpoeders hetgeen steeds meer wordt verdrongen door het plasmaspuiten. Dit laatste wordt nogal toegepast om lagen op te brengen die ook nog slijtvast dienen te zijn.
Claddings
Relatief dunne lagen metaal, dat zich edel en passief gedraagt, wordt m.b.v. een walsproces of door een explosieve lasproces opgebracht op het te beschermen metaal. Deze processen worden voornamelijk toegepast in de apparatenbouw. Voorbeelden zijn rompen voor reactorvaten en pijpplaten voor warmtewisselaars (afbeelding 7).
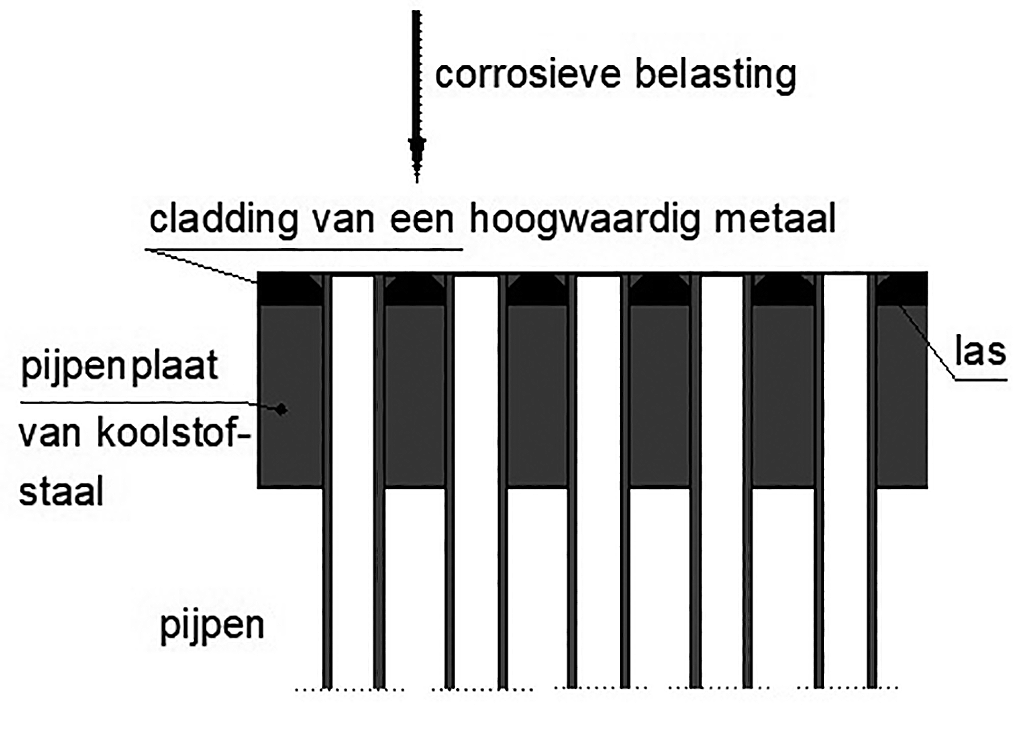
Afbeelding 7: Explosief aangebrachte cladding.
Verven en bitumen en plastics
Dit zijn niet-metallische deklagen die door onderdompelen, strijken of spuiten kunnen worden aangebracht. Plastics kunnen ook als folie worden verlijmd op de ondergrond. Het is een vereiste dat de lagen hermetisch dicht zijn, anders treedt in een kleine beschadiging een snelle aantasting op. Ook kunnen thermisch dergelijke lagen worden aangebracht zoals bijvoorbeeld door moffelen, vulcaniseren van rubber, epoxyharsen enz.
Er zijn tegenwoordig zeer goede verfsystemen ontwikkeld om metalen tegen corroderen te beschermen.
Anodiseren
Dit is een proces om de natuurlijke oxidefilm van bepaalde aluminiumlegeringen te vervangen door een veel dikkere oxidehuid die door middel van een elektrochemisch proces wordt verkregen. Deze oxidehuid, die na de behandeling poreus is, kan voordat deze wordt geseald met kokend water nog ingekleurd worden. Ook kan men elektrochemisch inkleuren. Op deze wijze ontstaan er allerlei aluminium voorwerpen die een veel hogere corrosiebestendigheid hebben verkregen. Een bekende toepassing is de utiliteitsbouw waar men veel geanodiseerde en gekleurde aluminium profielen gebruikt. Wel is het van belang dat het siliciumgehalte in deze aluminiumlegeringen niet te hoog is anders slaan de producten tijdens dit proces zwartachtig uit.
Polarisatie
Tenslotte verdient het begrip 'polarisatie' ook enige aandacht. Als in een galvanisch systeem corrosieproducten zich gaan afzetten op het anodische oppervlak, zal het duidelijk zijn dat deze niet elektrisch-geleidende laag moeilijk tot zeer moeilijk metaalionen af kan geven aan het elektrolyt. Bijvoorbeeld op een ijzer/zinkelement ontstaat aan de zinkanode een laag zinkhydroxide (Zn(OH)2) vanwege de reactie Zn++ + 2OH-. Dit zinkhydroxide vormt een afgesloten laag waardoor de corrosie geheel tot stilstand komt. Men noemt dit het polariseren van het corrosie-element. Indien er een beschadiging in deze laag komt, leidt het geen twijfel dat op deze plaats de aantasting zich in zeer hevige mate zal manifesteren. Ook kent men naast anodische- ook kathodische polarisatie. Beiden dienen hetzelfde doel, namelijk een weerstand opbouwen om een elektrische stroom te laten verlopen met als uiterste dat de stroom geheel geblokkeerd wordt. In ieder geval bewerkt polarisatie dus dat de elektromotorische kracht van een corrosie-element afneemt (zie afbeelding 8). En als deze afneemt dan neemt de corrosiesnelheid uiteraard ook af i.v.m. de afnemende ionenconcentratie.
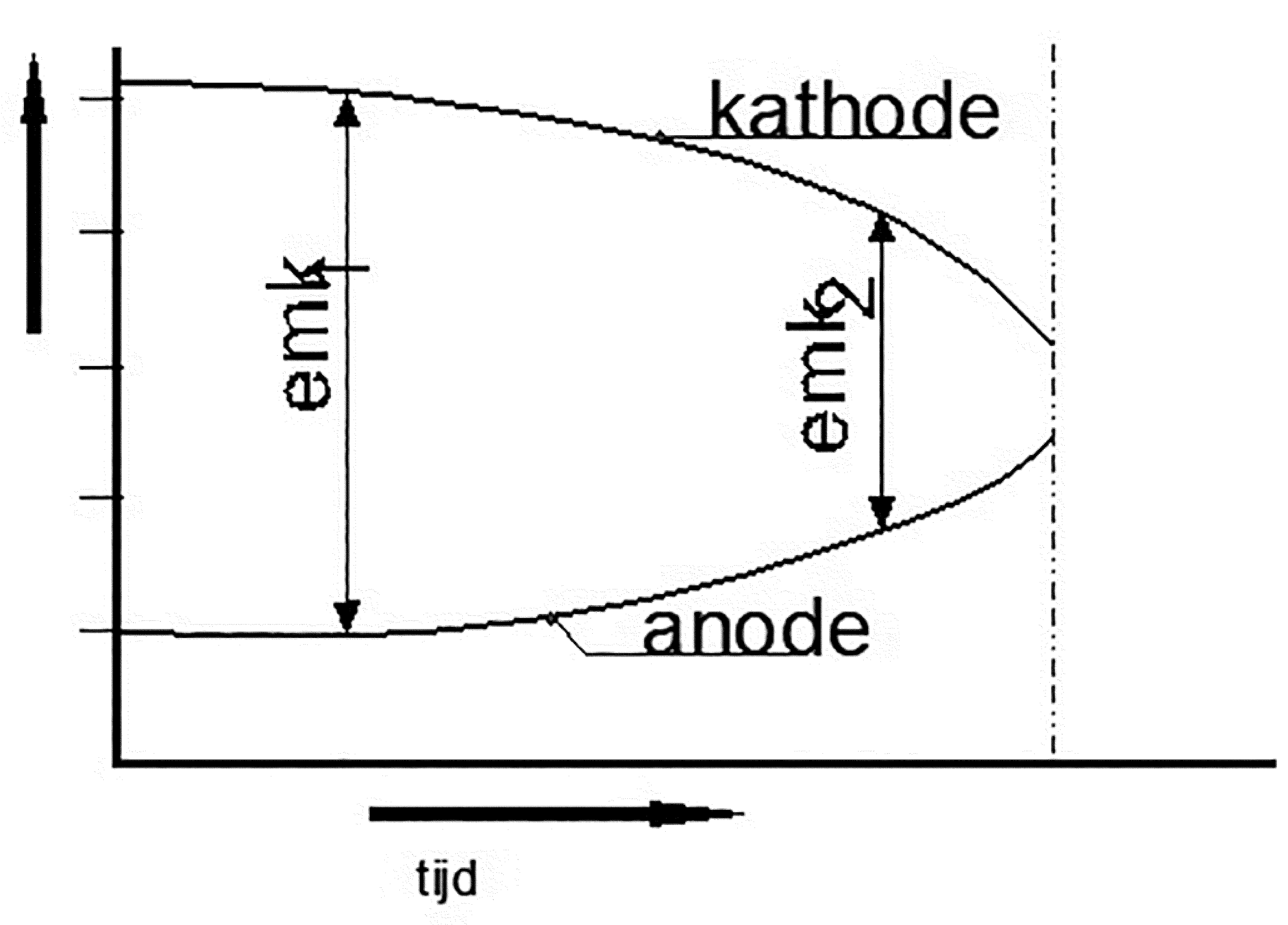
Afbeelding 8: Polarisatie van zowel de anode als de kathode, Emk2 < Emk1
De mate van polarisatie hangt ook af van het stromingsbeeld van het elektrolyt die bijvoorbeeld door turbulentie het ontstaan van dit fenomeen behoorlijk kan laten afnemen.
Slot
Uiteraard dient men beknopt te blijven in een dergelijk artikel als deze en daarom behoeft het geen betoog dat er zeer veel over bovenstaande processen te schrijven is. Ook zijn er nog veel meer andere methoden om corrosie te bestrijden zoals chloreren, fosfateren, scooperen, sheradiseren, alumineren, anodische bescherming, beheersing van het zuurstofgehalte e.d. Maar over het algemeen kan gesteld worden dat ook in de metaalwereld geldt: 'voorkomen is beter dan genezen' dus preventieve maatregelen om corrosie voor te zijn is meer dan gewenst. Daarom is het tijdens de ontwerpfase van groot belang dat de constructeurs zich zoveel mogelijk bezig houden met corrosie-ongevoelige constructies. Veelal blijkt door onkunde en onwetendheid dat er allerlei onnodige spleten en dode hoeken in een systeem zijn opgenomen die later tot aantastingen leiden. Ook de combinaties van diverse metaallegeringen worden soms te ondoordacht gekozen. Tot slot worden er in de afbeeldingen 9 en 10 enige voorbeelden gegeven die een illustratief aantonen wat men wel en niet moet doen tijdens het construeren. Voorts zal duidelijk zijn dat men m.b.v. kennis, logica, empirie en het nodige overleg tot besluiten zal komen die uiteindelijk zullen leiden tot de resultaten die men voor ogen had gesteld.
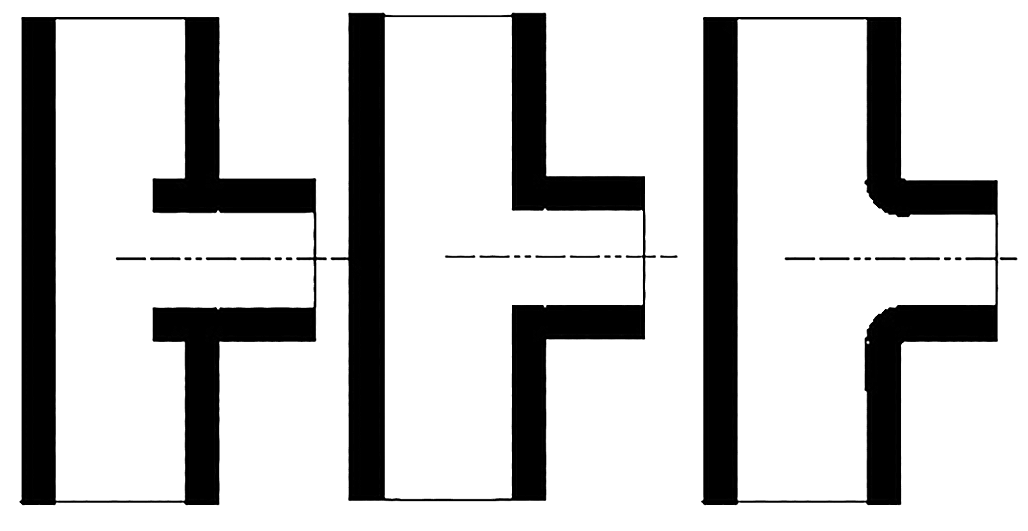
Afbeelding 9: Tee-stuk vermijd turbulentie, v.l.n.r. slecht, beter en goed.
Afbeelding 10: v.l.n.r. slecht, beter en goed.
literatuur:
Corrosiedictaat TU Enschede - Prof Gellings.
Corrosie en haar bestrijding: Dipl. Ing. H.G. Zelders - Technische Uitgeverij H. Stam.



