Corrosiegedrag van nikkel en zijn legeringen
Nikkel neemt met een evenwichtspotentiaal van -0,227 V een tussenplaats in in de elektrochemische reeks. Het is dus edeler dan zink en ijzer maar onedeler dan tin, lood en koper. Nikkel wordt beschouwd als een lichtelijk edel metaal en het blijkt in de praktijk goed bestand te zijn tegen zowel zure als basische oplossingen.
Door: A.J. Schornagel
Inleiding
Nikkel is thermodynamisch stabiel in neutrale en matig basische oplossingen, maar niet in zure of sterk basische oplossingen. Het metaal zal naar verwachting oplossen in zure oplossingen waarbij Ni2+ ionen worden gevormd en er H2 vrijkomt. Nikkel kan in neutrale en matig basische oplossingen passiveren door de vorming van een oppervlaktelaag van Ni(OH)2 en mogelijk NiO. In sterk basische oplossingen is nikkel instabiel, waarbij het oplost onder vorming van Ni(OH)3- ionen. In sterk oxiderende neutrale en basische condities kan nikkel passiveren door vorming van een NiOOH laag.
Anodisch gedrag van nikkel
Er staan vele anodische potentiaal-stroomdichtheid (E-i) krommen voor nikkel ter beschikking, die zijn opgemeten met potentiostatische, potentiokinetische en, vroeger, galvanostatische technieken. Helaas bestaat er lang niet altijd overeenstemming tussen de meetresultaten, afkomstig van verschillende bronnen. De voornaamste reden hiervoor is gelegen in de aard en hoeveelheid verontreinigingen in het metaal en in de oplossing, die beide van grote invloed zijn op de vorm van de kromme, en in variaties in experimentele procedure. Afbeelding 1 toont een kromme voor nikkel in 0,5 M H2SO4 waar de hoofdkenmerken van het anodisch gedrag van het metaal zijn te zien die van belang zijn voor zijn corrosieweerstand. Te zien is dat in zure oplossingen nikkel in staat is om te passiveren en dat de omvang van het passieve gebied (DE) aanzienlijk is: ongeveer 0,5 V. De passivering van nikkel in zure oplossing is een kenmerk dat niet wordt voorspeld door het potentiaal-pH evenwichtsdiagram. In de praktijk blijkt het passiverend vermogen en daarmee de weerstand tegen corrosie in zure oplossingen beter te zijn dan uit thermodynamische evenwichtsbeschouwingen blijkt. Een andere, mogelijk belangrijker reden, ligt in het feit dat in het actieve gebied (ABC) de anodische overpotentiaal aanzienlijk is omdat de uitwisselingsstroomdichtheid voor het in oplossing gaan van nikkel klein is. Dit, gekoppeld met het feit dat in de elektrochemische reeks nikkel slechts lichtelijk negatief is (Eev= -0,027 V) ten opzichte van het waterstof evenwicht, betekent dat in de praktijk de oplossnelheid van nikkel in zure oplossingen langzaam is in de afwezigheid van oxidanten die sterker zijn dan H+ of van stoffen die in staat zijn om de anodische reactie makkelijker te laten verlopen. De anodische oplossing van nikkel hangt ook af van de mate van koudvervorming van het metaal. In het actieve gebied is de anodische stroomdichtheid van koudvervormd metaal bij een gegeven potentiaal tot een orde van grootte hoger dan die van zachtgegloeid metaal.
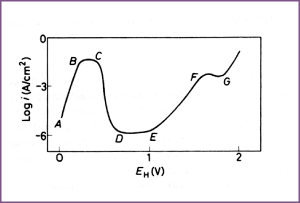
Afbeelding 1. Potentiostatische E-log i curve voor nikkel, anodisch gepolariseerd in 0,05 M H2SO4 dat is verzadigd met N2 bij 25°C.
Bij hoge potentialen in zure oplossingen wordt nikkel transpassief (EF), en in dit gebied treedt er hoofdzakelijk corrosie op op de korrelgrenzen, net als bij roestvast staal. In de passieve en transpassieve toestand resulteert anodisch oplossen in de vorming van Ni2+ ionen in oplossing. Bij nog hogere potentialen vertoont nikkel secundaire passiviteit (FG), en hoewel de anodestroom verscheidene orden van grootte hoger is dan in het passieve gebied (DE) blijft deze niet beperkt tot de korrelgrenzen. Bij potentialen boven het gebied van secundaire passiviteit neemt de anodische stroomdichtheid toe en verloopt het oplossen door de vorming van een oxidelaag, waarschijnlijk NiOOH en dat gaat vergezeld met ontwikkeling van O2. In dit gebied worden wederom de korrelgrenzen bij voorkeur aangetast. Het corrosiegedrag van nikkel in zure oplossingen in de gebieden van transpassiviteit, secundaire passiviteit en verder, is van beperkt praktische belang, omdat deze potentialen buiten het bereik van de redoxpotentialen van de meeste waterige oplossingen liggen.
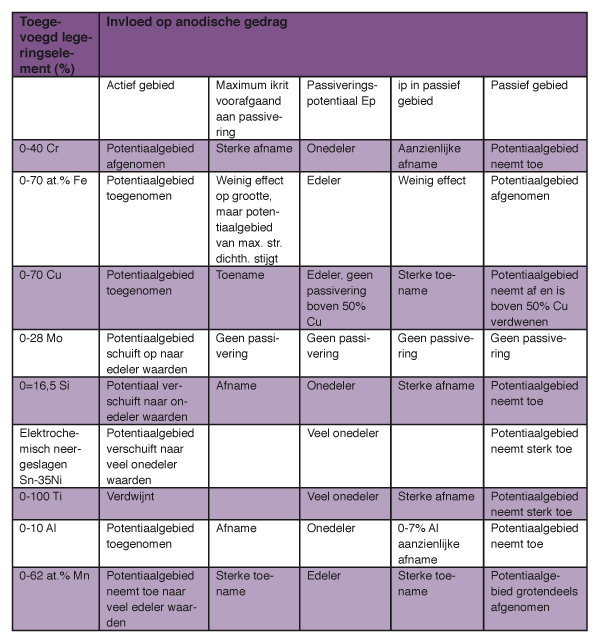
Invloed van legeren op anodisch gedrag van nikkel.
Boven temperaturen van 100°C blijkt nikkel in zure en neutrale oplossingen geen actief-passief overgang meer te vertonen (afbeelding 2). Net als bij de meeste andere metalen, wordt het anodisch gedrag van nikkel beïnvloed door de samenstelling van de oplossing waarin de metingen worden gedaan, met name als de oplossing zuur is. Zure oplossingen die Cl- ionen of bepaalde zwavelverbindingen bevatten hebben een uitgesproken invloed op zowel het laten stijgen van de snelheid van de anodische oplosreactie in het actieve gebied, op het verhinderen van passivering en op het stimuleren van plaatselijke corrosie. Thiourea en sommige afgeleiden hebben een complex effect, waarbij ze dan als anodische stimulator fungeren en dan weer als inhibitor, al naar gelang hun concentratie. In basische oplossingen, mogelijk met uitzondering van hoge concentraties bij verhoogde temperatuur, is nikkel gewoonlijk passief.
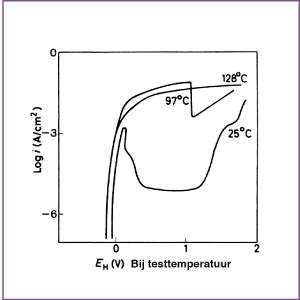
Afbeelding 2.
Effect van temperatuur op het anodisch gedrag van nikkel in 0,025 M H2SO4 + 0,025 M K2SO4 (pH 1,3) dat is ontlucht met H2. De curven zijn potentiokinetisch bepaald met een scansnelheid van 2 V/uur, lopend van negatief naar positief.
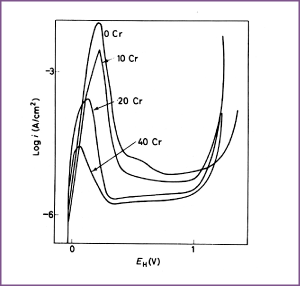
Afbeelding 3. Effect van chroomgehalte op het anodisch gedrag van Ni-Cr legeringen in 0,5 M H2SO4 (ontlucht met H2) bij 23°C. De potentiaal is in stappen van 0,023 V per 3 minuten verhoogd.
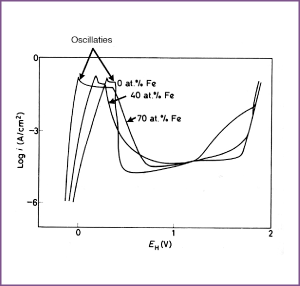
Afbeelding 4. E-log i verband voor het anodisch gedrag van Ni-Fe legeringen in 0,5 M H2SO4 (ontlucht met H2) bij 25°C.
Passiviteit van nikkel
In veel waterige oplossingen bezit nikkel het vermogen om passief te worden over een breed gebied pH waarden. Het mechanisme van passiveren van nikkel wordt in het algemeen toegeschreven aan de vorming van een film, bestaande uit oxide of gehydrateerd oxide, met een dikte van verscheidene nanometer (10-3 mm). Impedantie metingen suggereren dat de passieve laag, in ieder geval in zure oplossingen, elektrisch complex is en geen ideaal diëlektricum vormt. In bepaalde geconcentreerde zure oplossingen, zoals H2SO4, kan nikkel pseudo-passiviteit vertonen als gevolg van de vorming van een nikkelzout op het metaaloppervlak.
Afbeelding 5. Anodisch gedrag van Ni-Cu legeringen in 0,5 M H2SO4 (ontlucht met N2) bij 25°C, de curven zijn potentiokinetisch bepaald met 0,4 V/uur voor de 78,3% en 49,9% Ni legeringen en met 3 V/uur voor de 30,4% Ni legering, gaande van positievere naar negatievere potentiaalwaarden.
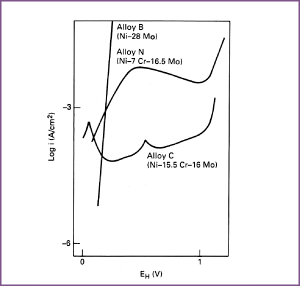
Afbeelding 6. Anodisch gedrag van Alloys B, C en N in kokend 10% H2SO4 (ontlucht met H2), de potentiaal is stapsgewijs verhoogd.
Invloed van legeren op het gedrag van nikkel
Potentiaal-(anodische) stroomdichtheidscurven die de invloed laten zien van afzonderlijke legeringselementen zijn de volgende: Cr - afbeelding 3; Fe - afbeelding 4; Cu - afbeelding 5; Mo - afbeelding 6 (curve voor Alloy B); Si - afbeelding 7. De gevolgtrekkingen uit deze curven zijn verzameld in tabel 1, waarbij bedacht dient te worden dat de meetgegevens grotendeels gelden voor de legeringen in H2SO4. Passiviteit wordt echter zowel door de samenstelling van de oplossing als die van het metaal beïnvloed en om die reden kan de invloed van legeringselementen anders zijn in oplossingen die andere ionen bevatten. Vooral Cl- en andere overeenkomstig agressieve ionen hebben een sterke invloed en kunnen passivering verhinderen, hetzij gedeeltelijk hetzij volledig. Als over het gehele metaaloppervlak geen passiviteit kan worden gehandhaafd, dan ontwikkelt zich putvormige aantasting. Grof gezegd valt de invloed van de legeringselementen uiteen in twee categorieën:
- zij die de passiviteit van nikkel verbeteren: Cr, Si, Sn, Ti en Al;
- zij die nikkel edeler maken: Cu en Mo.
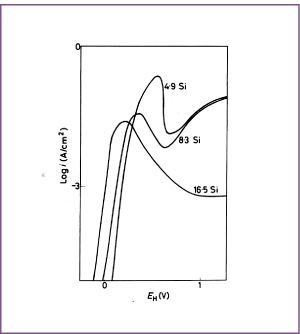
IJzer en mangaan vallen in geen van beide categorieën. Hoewel Ni-Fe legeringen kunnen worden gepassiveerd, is hun passiviteit minder dan die van nikkel en ze zijn ook minder edel dan nikkel. In de aanwezigheid van chroom kan ijzer echter een aanzienlijk gunstige invloed hebben op de passiviteit , zoals valt op te maken door de curve voor de legering Alloy 600 (Ni-15Cr-8Fe) van afbeelding 8 te vergelijken met de curven voor de binaire Ni-Cr en Ni-Fe van respectievelijk afbeelding 3 en 4. Legeringselementen die de passiviteit van nikkel versterken worden geacht de corrosieweerstand tegen oxiderende media te verbeteren, in het bijzonder zure oplossingen die oxidanten bevatten. Daar staat tegenover dat sterk oxiderende zuren zoals HNO3 en H2CrO4 of andere zure oplossingen die krachtige oxidanten bevatten zulke legeringen transpassief kunnen maken, waar de corrosieweerstand van te lijden kan hebben. In minder oxiderende media, met name in zure oplossingen waar waterstofontwikkeling het kathodische proces is, zijn niet alle legeringselementen die de passiviteit verbeteren even gunstig. In deze omstandigheden helpen chroom, silicium en waarschijnlijk aluminium niet erg. In tegenstelling hiermee is toevoeging van titanium en tin wel gunstig. Toevoeging van silicium is ook vaak gunstig, vooral bij expositie aan H2SO4. In verdund H2SO4 passiveren N-Si legeringen die ongeveer 10% Si bevatten niet spontaan, maar de snelheid van de anodische oplosreactie daalt snel tot een lage waarde wegens de vorming van een silicium rijke oppervlaktelaag. In geconcentreerd H2SO4 zijn zulke Ni-Si legeringen passief, terwijl in gemiddeld verdund H2SO4 het corrosiegedrag vrij complex is.
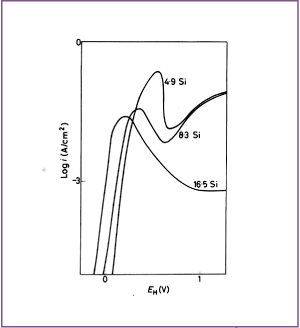
Afbeelding 7. Anodisch gedrag van Ni-Si legeringen in 25% H2SO4 (ontlucht met N2), bij omgevingstemperatuur.
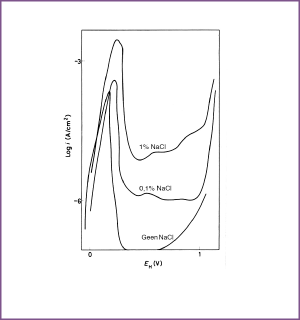
Afbeelding 8. Anodisch gedrag van Alloy 600 in 0,5 M H2SO4 (ontlucht met N2), dat verschillende concentraties Cl- ionen bevat, bij 24°C.
De legeringselementen molybdeen en koper verhogen van zichzelf niet de passiviteit van nikkel in zure oplossingen, maar maken in plaats daarvan het metaal edeler. Dit betekent dat in de praktijk deze legeringselementen een gunstige invloed uitoefenen in precies die omstandigheden waar chroom het laat afweten, namelijk in zure oplossing waar waterstofontwikkeling kan plaatsvinden. Zij doen dit door de snelheid van de anodische oplosreactie te vertragen. In sterker oxiderende media stijgt de anodische activiteit en, omdat binaire Ni-Mo en Ni-Cu legeringen niet passiveren in zure oplossingen, zijn ze in het algemeen ongeschikt voor dergelijke media. Betrekkelijk kleine hoeveelheden molybdeen in Ni-Cr-Fe legeringen, zoals roestvast staal, maken passivering veel gemakkelijker en uit afbeelding 9 valt op te maken dat een verdere toevoeging van 2% Cu dit effect versterkt. Het belangrijkste effect is de reductie van de maximum stroomdichtheid, ikrit, die aan passivering voorafgaat, maar ook de stroomdichtheid, ip, in het passieve gebied wordt verlaagd. Wegens de invloed op ikrit vertonen Ni-Cr-Fe-Mo en Ni-Cr-Fe-Mo-Cu legeringen goede corrosieweerstand in zure oplossingen zowel onder oxiderende condities en als de corrosie vergezeld gaat met waterstofontwikkeling. Toevoeging van chroom aan Ni-Mo legeringen die ongeveer 15% Mo bevatten verschaft passiviteit. Chroom verschuift echter bij deze legeringen het actieve gebied naar negatievere potentialen, zodat de chroomhoudende legeringen een hogere corrosieweerstand hebben dan de chroomvrije legeringen in oxiderende media, ze minder resistent zijn in de meeste waterstofontwikkelende zure oplossingen.
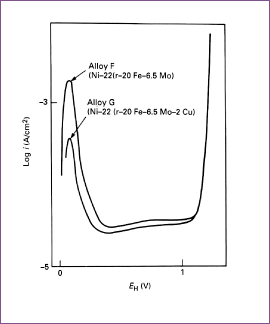
Afbeelding 9. Anodisch gedrag van Alloys F en G in kokend 10% H2SO4 (ontlucht met H2), de potentiaal werd elke 3 minuten verhoogd.



