Wat is aluminium? Deel 4
Aluminium dankt zijn populariteit voor een groot gedeelte aan de corrosiebestendigheid. Vooral tegen weersinvloeden is het metaal goed bestand, wat in de bouw tientallen toepassingen heeft opgeleverd. Net als b.v. bij roestvast staal wordt de corrosiebestendigheid van aluminium veroorzaakt door de aanwezigheid van een dun goed hechtend en sluitend oxidelaagje op het metaaloppervlak. Een dergelijk laagje beschermt in het algemeen goed tegen gelijkmatige aantasting van het oppervlak, helaas is het soms niet bestand om weerstand te bieden tegen verraderlijke corrosievormen als spanningscorrosie en putcorrosie. In dit artikel wordt corrosie van aluminium behandeld en worden enkele corrosiebeschermingsmethoden aangestipt.
Corrosie van aluminium
Aluminium is een onedel metaal, dat dan ook snel oxideert. Binnen enkele seconden is een oxidelaagje op het oppervlak gevormd. Dit laagje is echter dermate flexibel, goed hechtend, afsluitend en chemisch bestendig, dat het het onderliggende aluminiumoppervlak tegen verdere aantasting beschermt. Verdere gelijkmatige aantasting kan slechts ontstaan als het oxidelaagje door slijtage of oplossing in chemische stoffen wordt ondermijnd. Een metaal dat onder bovenbeschreven omstandigheden wordt beschermd, verkeert in de passieve toestand, het metaal doet dan immers niet mee aan het corrosieproces. Andere voorbeelden van metalen of legeringen welke zich in het algemeen passief gedragen zijn chroom, zink en roestvast staal. Blootgesteld aan b.v. sterk zure of basische milieus, lost de beschermende oxidelaag van dergelijk!! metalen op, waardoor ze zich actief gaan gedragen, m.a.w. ze worden aangetast. Afb. 1 geeft de corrosiesnelheid van aluminium (uitgedrukt in gewichtsafname per vierkante meter per uur) als functie van de pH-waarde. Bij lage en hoge pH-waarden is het metaaloppervlak actief. In het algemeen is corrosie van metalen een elektrochemisch proces. Dit wil zeggen, dat er elektronenoverdracht tussen het milieu en het metaal optreedt. Afb. 2 toont een principetekening van elektrochemische corrosie. Volgens dit mechanisme gaat het minst edele gedeelte (de anode) in oplossing volgens de reactie: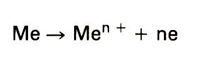
Waarbij 'Me' staat voor een willekeurig metaalatoom, 'n' voor het aantal aan de reactie deelnemende elektronen en 'e' voor elektron(en). De Me n + ionen binden zich met stoffen uit het milieu tot de corrosieprodukten. Bij het edele gedeelte (de kathode) vinden reacties in het milieu plaats, met het metaal zelf gebeurt hier niets. Een voorbeeld van een kathodische reactie die veelvuldig in zwak zure milieus voorkomt is: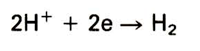
Bij de anode blijven tijdens het in oplossing gaan van het metaal elektronen in het metaal achter, bij de kathode worden, tijdens omzetting van componenten uit het milieu, elektronen door het metaal afgegeven. M.a.w.: De anode is een elektronenacceptor, de kathode is een elektronendonor. Het corrosieproces van afb. 2, waarbij twee metalen met een verschillende potentiaal elektrisch met elkaar in verbinding staan, wordt galvanische corrosie genoemd. In feite zijn de meeste corrosieprocessen op deze corrosievorm gebaseerd. Bijvoorbeeld bij gelijkmatige corrosie bevinden zich over het oppervlak verspreid-ontelbare anodes en kathodes. Deze gebiedjes met verschillende potentiaal komen voort uit de microstructuur en uit onregelmatigheden aan de metaal- en milieuzijde van het oppervlak. T.g.v. het corrosieproces, veranderen bij gelijkmatige corrosie de anodes en kathodes voortdurend waardoor het oppervlak gelijkmatig wordt aangetast.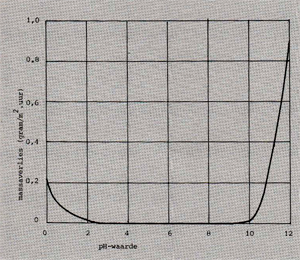
Afb. 1: Invloed van de pH op de corrosiesnelheid van aluminium.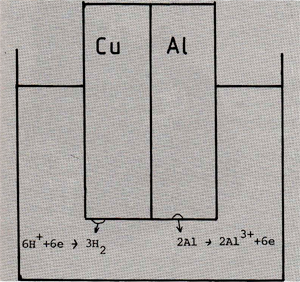
Afb. 2: Principeschets van het verloop van elektrochemische corrosie. Aan de kathode (in dit geval koper) vinden de kathodische reacties plaats, aan de anode (aluminium) vinden de anodische reacties plaats, wat het in oplossing gaan van aluminium inhoudt.
Galvanische corrosie
Het corrosiemechanisme is hierboven al beschreven en in afb. 2 weergegeven. De mate van 'edelheid' van een metaal kan aan de hand van potentiaalmetingen worden bepaald. Hierbij wordt het te meten metaal in een bepaalde oplossing gehangen waarna de potentiaal (spanning) t.o.v. een referentie-elektrode wordt gemeten.
Afb. 3a toont de zgn. normaalpotentialen van enkele metalen. Dit zijn potentialen welke onder genormaliseerde omstandigheden zijn gemeten. In de praktijk komen potentiaalmetingen vaak anders uit omdat het milieu een grote invloed heeft op de potentiaal welke een metaal t.o.v. de referentie-elektrode aanneemt. Tevens speelt de eventuele aanwezigheid van een beschermende oxidehuid een grote rol. Afb. 3b toont potentiaalmeting resultaten van dezelfde metalen als afb. 3a, echter in leidingwater met pH=6. Aluminium blijkt nu veel hoger te staan, zelfs boven staal. Uit deze metingen kan worden opgemaakt dat aluminium in leidingwater wordt beschermd door zijn oxidehuid (evenals tin en lood). Afb. 3c toont potentiaalmeting resultaten van de verschillende metalen in zeewater. Hier gedraagt aluminium zich actief, waardoor de potentiaal aanzienlijk is gedaald. In hoeverre galvanische corrosie optreedt, hangt af van een drietal factoren:
- De grootte van het potentiaalverschil tussen de twee metalen. Dit verschil is b.v. tussen aluminium en koper dermate groot dat in een vochtig milieu vrijwel altijd galvanische corrosie optreedt.
- De elektrische geleidbaarheid van het milieu. In zout water verloopt galvanische corrosie veel sneller dan in leidingwater.
- De oppervlakteverhouding tussen de twee metalen.
Erg ongunstig is een groot kathodisch (edel) oppervlak en een klein anodisch (onedel) oppervlak. Aan de anode heerst dan een hoge stroomdichtheid met als gevolg een hoge corrosiesnelheid. Vandaar dat bij wijze van spreken, het verbinden van aluminium plaat met koperen bouten minder ongunstig is dan koperen plaat te verbinden met aluminium bouten.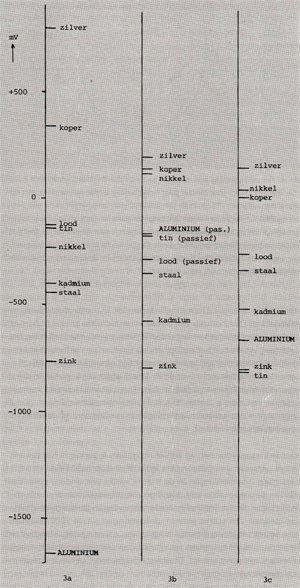
Afb. 3: Normaalpotentialen van enkele metalen (afb. 3a). Let op de lage potentiaal (onedel) van aluminium. In afb. 3b is de potentiaal van enkele metalen in leidingwater (pH= 6) weergegeven (t.o.v. zilver-zilverchloride elektrode). Let op de hoge plaats van het (passieve) aluminium. In zeewater wordt aluminium niet meer beschermd door zijn oxidehuid, wat uit de relatief lage potentiaal is op te maken (zie afb. 3c, gemeten t.o.v. zilver-zilverchloride elektrode).
Putcorrosie
Ook het mechanisme achter putcorrosie is terug te brengen naar galvanische corrosie. Putten kunnen bijvoorbeeld ontstaan op uitscheidingen van legeringselementen. Een berucht voorbeeld is putcorrosie in aluminium-koperlegeringen. T.g.v. het grote potentiaalverschil tussen koper en aluminium, zal het aluminium rond koperhoudende uitscheidingen versneld oplossen waardoor putten ontstaan. Bij zich passief gedragende metalen als aluminium kan putcorrosie ook op zwakke plekken in de oxidehuid ontstaan. Als derde oorzaak van het ontstaan van putcorrosie kunnen onregelmatigheden op het oppervlak aan de milieuzijde worden genoemd. Hierbij kan gedacht worden aan een luchtbel (in een vloeibare atmosfeer) of aan een vloeistofdruppel (in een droge atmosfeer). Afb. 4 geeft aan waarom een put na initiatie versneld uit kan groeien. De put zelf gedraagt zich anodisch, hier lost het metaal op, waardoor positieve metaalionen ontstaan. Net naast de put bevindt zich het kathodische gebied. In zuurstofrijke milieus is de reductie van zuurstof een veelvuldig voorkomende kathodische reactie. Doordat het gebied rond de put kathodisch is en door de aanwezigheid van het beschermende oxidehuidje aldaar, wordt het gebied in de onmiddellijke omgeving van de put goed tegen corrosie beschermd. Slechts materiaal in de put kan oplossen, waardoor putten tot grote diepte kunnen uitgroeien, soms tot vele millimeters. Daarnaast wordt de agressiviteit van de vloeistof in de put aanzienlijk verhoogd doordat agressieve chloride-ionen door de positieve metaalionen worden aangetrokken.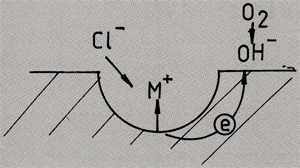
Afb. 4: Principetekening van de groei van een put. In de put vinden de anodische reacties plaats (het metaal gaat in oplossing onder de vorming van positieve metaalionen i. Ter herstel van het elektrisch evenwicht in de put worden agressieve negatieve ionen als chlorideionen aangetrokken. T.g.v. van verhoging van de agressiviteit blijft het oppervlak van de put actief. Het gebied in de onmiddelijke omgeving van de put wordt kathodisch beschermd. Hier vinden de kathodische reacties plaats, waarvan de reductie van zuurstof een voorbeeld is.
Afb. 5 toont enkele putten in het oppervlak van een aluminium gietlegering. Deze putten zijn mede versneld uitgegroeid t.g.v. het potentiaalverschil tussen het dendritische en het interdendritische materiaal, waardoor het putoppervlak (en ook de rest van het oppervlak van het metaal) een 'sponsachtig' uiterlijk krijgen. Afb. 6 toont het bovenaanzicht van de in afb. 5 afgebeelde put, nadat het oppervlak gepolijst en geëtst is. Afb. 7 laat een doorsnede van een gedeelte van deze put zien. Op de laatste twee afbeeldingen is duidelijk te zien dat het interdendritische materiaal om de dendrieten wegcorrodeert.
Door te kiezen voor een zo zuiver mogelijke legering is het gevaar op het ontstaan van putcorrosie klein. Het materiaal bevat dan immers geen uitscheidingen in de matrix welke een andere potentiaal bezitten dan de matrix zelf. Vandaar dat vrijwel zuiver aluminium als de legering AA 1090 zeer bestendig is tegen putcorrosie. Het zgn. cladden van sterke aluminiumlegeringen uit de 2000- en 7000- serie wordt uitgevoerd ter verhoging van de corrosiebestendigheid. Op sterke aluminium plaat wordt dan een corrosiebestendig laagje zuiver aluminium gewalst. Deze legeringen worden 'Aiclad legeringen' genoemd.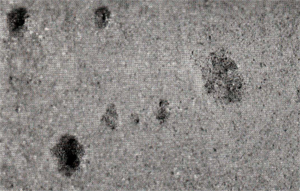
Afb. 5: Putcorrosie in het oppervlak van een aluminium gietlegering.
Interkristallijne corrosie
Bij interkristallijne corrosie worden de korrelgrenzen selectief aangetast waardoor de korrels op den duur uitbreken. Afb. 8 laat de doorsnede van een door interkristallijne corrosie aangetaste aluminium plaat (AIMg5) zien. Ook deze corrosievorm kan teruggebracht worden tot galvanische corrosie. De aantasting vindt plaats op uitscheidingen op de korrelgrenzen. Dit houdt weer in dat vooral hooggelegeerde legeringen gevoelig kunnen worden voor interkristallijne corrosie. Laaggelegeerde en niet gelegeerde aluminiumlegeringen scheiden immers geen of vrijwel geen intermetallische verbindingen uit. Koper en magnesiumhoudende legeringen kunnen gevoelig zijn voor interkristallijne corrosie. Bij aluminium magnesium legeringen moet het magnesiumgehalte hoger dan 3% zijn. In dat geval kunnen na een bepaalde warmtebehandeling (tussen 80 en 200 °C) AI 3Mg2 deeltjes op de grenzen uitscheiden. Deze deeltjes zijn onedeler dan de matrix waardoor ze, blootgesteld aan een corrosief milieu, in oplossing gaan. Wat koperhoudende legeringen betreft, scheiden na een bepaalde warmtebehandeling (tussen 80 en 200 °C) CuAI2 deeltjes uit de matrix uit op de korrelgrenzen. Ook zinkhoudende legeringen kunnen bij een hoog zinkgehalte gevoelig worden voor interkristallijne corrosie.
Bij bovengenoemde legeringen dient men dus voorzichtig om te springen met het verwarmen van het materiaal. Indien dergelijke legeringen toch een voor interkristallijne corrosie ongunstige warmtebehandeling hebben ondergaan (b.v. na lassen, uitharden etc.) dan moet het materiaal 'gestabiliseerd' worden. Dit houdt in, dat het gedurende enige tijd gegloeid dient te worden op een temperatuur waarbij de uitgescheiden intermetallische verbindingen weer oplossen. Deze temperatuur is afhankelijk van de legeringssamenstelling.
Afb. 6: Bovenaanzicht van één van de putten van afb. 5. Het oppervlak is gepolijst en geëtst. De dendritische structuur wijst op een gietlegering. Vergroting: 50x
Afb. 7: Doorsnede van een gedeelte van één van de putten van afb. 5. Duidelijk is te zien dat het interdendritische materiaal het' eerst wordt aangetast. Gepolijst en geëtst. Vergroting: 50X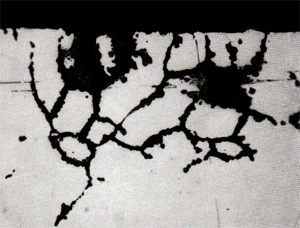
Afb. 8: Doorsnede van door interkristallijne corrosie aangetaste plaat (AIMg5 legering). Duidelijk is te zien dat de korrelgrenzen worden aangetast terwijl de korrels zelf intact blijven. Gepolijst, niet geëtst, vergroting : 200x
Spanningscorrosie
Spanningscorrosie treedt op als een metaal of legering wordt blootgesteld aan een corrosief milieu en inwendige of uitwendige spanningen. Het corrosiebeeld manifesteert zich in de vorm van scheuren, welke op den duur tot breuk leiden. Vanwege hoge inwendige spanningen is een sterk verstevigde legering als de AA 5056-H18 veel gevoeliger voor spanningscorrosie dan de spanningsarme legering AA 5056-0. Een grote rol bij het eventueel optreden van spanningscorrosie spelen de aard, de vorm en de verdeling van uitscheidingen. Vandaar dat ook warmtebehandelingen de spanningscorrosiegevoeligheid kunnen beïnvloeden. Door toevoeging van legeringselementen als chroom, zirkoon, vanadium en zilver wordt de weerstand tegen spanningscorrosie verhoogd. B.v. aan de AA 7075 legering wordt 0,25% chroom ter bestrijding van spanningscorrosie toegevoegd.
Andere corrosievormen
Vermeldenswaard is nog het fenomeen spleetcorrosie. Het mechanisme lijkt op dat van putcorrosie, alleen hoeft bij spleetcorrosie geen initiatie plaats te vinden omdat de spleet er eenvoudigweg al is. Bij spleetcorrosie speelt ook het zuurstofgehalte een grote rol. In de spleet zal het zuurstofgehalte t.g.v. reacties tussen metaalionen en zuurstof snel dalen. Is het zuurstofgehalte buiten de spleet hoog, dan ontstaat t .g.v. het zuurstofconcentratieverschil in en buiten de spleet een potentiaalverschil tussen het spleetoppervlak en het oppervlak buiten de spleet, waarbij de spleet de laagste potentiaal aanneemt. Hierdoor vindt het corrosieproces versneld plaats. Het optreden van spleetcorrosie is alleen in vochtige milieus een reëel gevaar, wat het beste bestreden kan worden door zodanig te construeren dat het ontstaan van spleten zoveel mogelijk wordt vermeden. Eventueel kan een spleet met b.v. siliconenkit worden afgedicht. Andere corrosievormen welke bij aluminium voorkomen, zijn: filiforme- of draadvormige corrosie (hierbij wordt het aluminiumoppervlak onder een coating door een corrosietype wat zich in draadvorm voortplant aangetast) en erosie-corrosie (slijtage wordt versneld door corrosie).
Gezondheidsaspecten
Aluminium wordt veelvuldig ingezet bij opslag, transport, verpakking en bereiding van levens- en genotmiddelen. Hierbij hoeft slechts gedacht te worden aan het grote toepassingsgebied van aluminiumfolie, wat veelvuldig voor verpakking wordt toegepast. Ook veel keukenmateriaal als pannen wordt van aluminium gemaakt. Deze toepassingen zijn te danken aan de chemische bestendigheid, de gunstige fysische eigenschappen en aan het feit dat aluminium in principe niet schadeljjk is voor de gezondheid. Aluminium komt van nature al in veel stoffen voor (b.v. in spinazie : 250- 600 mg/kg) en het element speelt zelfs een grote rol bij het functioneren van het menselijk gestel. Slt1chts grote doses aluminium kunnen de gezondheid schaden, onderzoek heeft uitgewezen dat een overdosis de werking van het geheugen nadelig beïnvloed (1) (2).
Uit afb. 1 kan worden opgemaakt dat aluminium niet bestand is tegen sterk zure milieus. Vandaar dat opslag van voedingsmiddelen als augurken en zilveruitjes in aluminium wordt afgeraden. In tegenstelling tot zware metalen, is van aluminium niet bekend dat het tijdens circulatie in het milieu enig gevaar voor ziekten als kanker kan opleveren.
Oppervlaktebescherming
Ondanks de redelijke bescherming welke aluminium van zijn oxidelaagje geniet, wordt de bescherming van het oppervlak nog vaak verbeterd. Een veelvuldig toegepaste methode is het zgn. anodiseren van aluminium, hierbij wordt een oxidelaag van een hoge kwaliteit d.m.v. een elektrochemisch proces aangebracht. Vooral vanwege esthetische aspecten wordt lakken van aluminium regelmatig toegepast. Hierbij wordt gebruik gemaakt van natte laksystemen en poederlakken.
Anodiseren
Anodiseren is een proces wat verbetering van de natuurlijke oxidehuid mogelijk maakt. Het te anodiseren produkt dient schoon te zijn en de natuurlijke oxidelaag moet worden verwijderd. Hiertoe wordt het oppervlak gebeitst. Er zijn zure en alkalische beitsmiddelen in de handel, het beitsproces bepaalt mede het uiteindelijke uiterlijk van het oppervlak. Na het beitsen worden de te anodiseren produkten in een zwavelzuurbad opgehangen waarna ze met de positieve pool van een gelijkstroombron (anode) worden verbonden. Als negatieve pool (kathode) kan een willekeurig zich in het bad bevindend stuk aluminium worden toegepast. Na inschakel.en van de stroom, zal de anode (produkt) versneld oxideren volgens de reaktie:
2Al + 3H20 → Al203 + 3H2
T.g .v. dit proces wordt een relatief dikke, goed hechtende oxidelaag gevormd. Afb. 9 toont een principeschets van deze oxidelaag, de dikte is ongeveer 20 µm. Het bovenste gedeelte is poreus, terwijl het onmiddellijk aan het metaal grenzende gedeelte een dichte structuur bezit. Deze structuur maakt het oppervlak zeer geschikt voor inkleuring omdat een kleurstof zich goed in de poriën kan vastzetten. De eenvoudigste manier van inkleuren is onderdompelen van het produkt in een kleurstof. Het is zelfs mogelijk om de laag m.b.v. een textielverf in te kleuren. Na een dergelijke inkleuring, worden de produkten enige tijd aan kokend water blootgesteld waardoor de poriën goed worden afgedicht. Dit proces wordt sealen genoemd. Veelvuldig wordt ook het zgn. elektrolytisch inkleuren toegepast. Hierbij worden de poriën m.b.v. een elektrolytisch proces gevuld met kleine metaaldeeltjes als tin, kobalt, nikkel en koper. Voor een dergelijke inkleuring worden de produkten, ondergedompeld in een metaalzoutoplossing, aan een wisselstroom blootgesteld. De eerste toepassingen op dit gebied leverden de bekende bronskleur op. Deze kleur ontstaat doordat blauw licht (korte golflengte) sterker wordt geabsorbeerd door het metaallaagje dan elektromagnetische golven met een grotere golflengte. Hierdoor verschuift de kleur in de rode richting. De kleur van de laag is sterk afhankelijk van de opgelegde spanning en van de tijd van blootstelling aan die spanning. Afb. 10 geeft een diagram van elektrolytische inkleuring in tinsulfaat waarbij de wisselspanning is uitgezet tegen de tijd.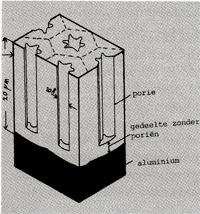
Afb. 9: Structuur van de oxidelaag welke t.g.v. anodiseren ontstaat.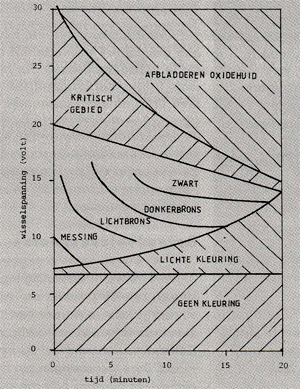
Afb. 10: Invloed van de wisselspanning en tijd op het inkleuren van aluminium produkten, ondergedompeld in een tinsulfaatoplossing.
Lakken
Vanwege de steeds betere kwaliteit van de coating, beleeft toepassing van gelakt aluminium een sterke opkomst. Het voordeel van lakken t.o.v. gekleurd anodiseren is, dat bij lakken veel meer kleuren mogelijk zijn.
Het op het aluminium altijd aanwezige oxidelaagje heeft een ongunstige invloed op de hechting van de aan te brengen laklaag. Vandaar dat de voorbehandeling bij het lakken een belangrijke rol speelt. Deze wordt als volgt uitgevoerd:
- Reinigen en ontvetten van het oppervlak
- Aanbrengen van een chromaatfluoridelaag. Deze corrosiewerende laag, welke zowel door dompelen of sproeien kan worden aangebracht, geeft een uitstekende ondergrond voor een laklaag.
In het algemeen wordt de lak elektrostatisch aangebracht. Elektrisch geladen lakdeeltjes worden verstoven, waarna ze door het tegengesteld geladen aluminiumoppervlak worden aangetrokken. Veelvuldig wordt poeder i.p.v. natte lak toegepast. Na uitharding in een oven wordt een gelijkmatig verdeelde, goed hechtende coating verkregen. Afb. 11 toont het elektrostatisch aanbrengen van lakpoeder op aluminium profielen. Na door de lakstraat te zijn gegaan, worden de 'gepoederde' profielen door een oven geleid waar de coating uithardt.
Een nieuwe ontwikkeling is het zgn. duplex systeem, waarbij het elektrolytisch ingekleurd geanodiseerd oppervlak d.m.v. hogedruk spuittechnieken van een laklaag wordt voorzien (3). Dergelijke duplexsystemen zijn goed hechtend en de onderliggende metaallaag (van het elektrolytisch inkleuren) absorbeert ultraviolette stralen waardoor dergelijke voor de lak schadelijke straling niet een tweede maal door de laklaag gaat. Daarnaast geeft het onderliggende metaallaagje aan de laklaag een bijzonder kleureffect.
Afb. 11: Elektrostatisch aanbrengen van lakpoeder op aluminium produkten.
Literatuur:
1. Aluminium and health; The aluminium association, Washington 1979.
2. Cooking utensils, some facts about their safety; HEW publ. No. FDA 80-2123-US, Dept. of health, education and welfare, food and drug administration, Rockville, Md. 1979.
3. A breakthrough in colour; Engineering, sept. 1984.
4. W. Hufnagel: Aluminium Taschenbuch, Aluminium Verlag Düsseldorf 1984.



