Blog Ko Buijs - De configuratie van een kristalrooster
Onderzoek met röntgenstralen hebben aangetoond, dat een metaalkristal is opgebouwd uitatomen die volgens een bepaald patroon ruimtelijk zijn gerangschikt. De onderlinge afstand van deze atomen is in de meeste gevallen 2 tot 3x10-8cm ofwel 2 tot 3 Ångström. De atomen waaruit het betreffende metaal bestaat, zullen dan een of meer van hun buitenste elektronen afstaan aan het metaalrooster. Dit worden ook wel de valentie-elektronen genoemd en een kenmerk is dat zij een zwakke binding hebben met de atoomkern.
Door Ko Buijs - Innomet Consultancy BV
Deze elektronen kunnenzich daarom vrij tussen de ontstane ionen bewegen waardoor een metaal een elektrisch geleidingsvermogen heeft gekregen. De positief geladen ionen worden naar elkaar toegetrokken dankzij de negatieve elektronen die zich ertussen bevinden. Op deze wijze zorgen de elektronen voor de nodige onderlinge cohesie. Dat bewerkt weer het samenspel van krachten die de onderlinge samenhang in de kristallen veroorzaakt. Hoewel het woord ionen op zich juist is, spreekt men in de praktijk toch meestal over atomen. Atomen staan niet stil, maar trillen om hun evenwichtstoestand heen en wel des te sterker naarmate de temperatuur hoger wordt. Men noemt dit de warmtebeweging van atomen.
In de meeste metalen is deamplitude van deze trillingen bij kamertemperatuur slechts enkele procenten van de onderlinge afstand. De atoomtrillingen hinderen de vrije elektronen bij hun loop tussen de atomen door. Dit leidt ertoe dat er een elektrische weerstand ontstaat in een metaal dat verder stijgt bij een toenemende temperatuur. Bij een bepaalde temperatuur worden de trillingen tenslotte zo hevig, dat de onderlinge samenhang verloren gaat waardoor het metaal gaat smelten. Als een metaal het absolute nulpunt bij – 273oC bereikt, staan de atomen stil waardoor de elektrische weerstand wegvalt. Dat kan dus ook supergeleiding genoemd worden. Regelmatige rangschikking van atomen betekent dat het kristalrooster voorgesteld kan worden als kleine gelijkvormige kubussen, die door stapeling in alle richtingen een bepaalderuimte vullen. Onderstaand worden de meest voorkomende kristalsystemen genoemd, die bij metalen voor kunnen komen (afbeelding 1).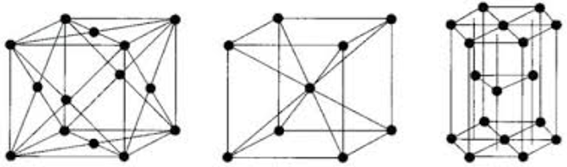
Afbeelding 1: v.l.n.r. KVG en KRG gecentreerd rooster alsmede een hexagonaal rooster.
Een kubisch ruimtelijk gecentreerd rooster (KRG).
Bij ferriet is het rooster kubisch ruimtelijk gecentreerd dat kortweg KRG wordt genoemd. De elementaire cel is een denkbeeldige kubus waarbinnen zich in het middelpunt nog een atoom bevindt. Deze structuur hebben onder andere chroom, molybdeen, wolfraam en ijzer. Dat laatste element heeft dit bij kamertemperatuur. Deze configuratie is te magnetiseren in het geval van ijzer.
Een kubisch vlakken gecentreerd rooster (KVG).
Bij austeniet is het rooster kubisch vlakken gecentreerd dat kortweg KVG wordt genoemd. De elementaire cel is een denkbeeldige kubus met een atoom in het midden van elk zijvlak. Deze structuur hebben onder andere zilver, aluminium, kobalt, koper, nikkel, lood en ook ijzer bij hoge temperaturen. Deze configuratie is in het geval van ijzer bij hoge temperaturen niet te magnetiseren.
Een hexagonaal rooster.
Het elementaire hexagonaal ruimtelijk element is een regelmatig zeszijdig prisma. Bij dit roostertype heeft de elementaire cel een zeshoekige vorm. Deze structuur hebben onder andere de metalen magnesium, titaan, zirkoon en zink. Een kenmerk is dat deze structuur slechts twee glijvakken heeft waardoor dergelijke metalen zich stug gedragen tijdens het deformeren. Een KRG-rooster heeft namelijk zes glijvlakken en een KVG-rooster maar liefst 12. D.w.z. dat een KVG-rooster het beste te deformeren is. Een metaal wordt kristallijn genoemd als de atomen van dat metaal over bepaalde atomaire afstanden zijn gerangschikt in een regelmatig driedimensionaal patroon. Zo ontstaat een kristalrooster. Materialen waarbij een dergelijke regelmaat niet bestaat, worden kristalloosgenoemd ofwel amorf, dat vormloos betekent. Met kristallen bedoelen we atomen en ionen als harde bolletjes met een gedefinieerde diameter. Met dit atoommodel laat de kristallijne opbouw zich goed beschrijven.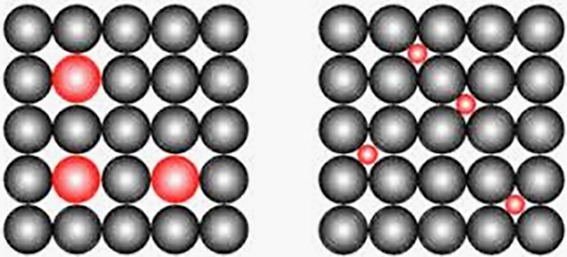
Afbeelding 2: links substitutionele en rechts interstitiële atomen (tekening Innomet Consultancy).
Indien een atoom zich interstitieel plaatst in een kristalrooster, zullen deze opgeloste atomen een plaats krijgen in de holtes tussen de atomen van het betreffende metaal (afbeelding 2). In zo'n geval wordt gesteld dat de opgeloste atomen interstitieel opgelost zijn. Voorbeeldenhiervan zijn stikstof of koolstof dat in ijzer oplost. Zo'n plaatsing wordt uiteraard bevorderd door kleine afmetingen van de opgeloste atomen. De elementen waterstof, stikstof, borium, zuurstof en koolstof lossen dan ook vaak interstitieel op. Hoewel de interstitiële plaatsing veel minder vaak voorkomt dan de substitutionele, zijn de gevallen waarin het voorkomt metaalkundig en sterkte-technisch van belang. Bij substitutionele plaatsing neemt het ‘vreemde’ atoom de plaats in van een metaalatoom dat tot het betreffende metaal behoort.




