Blog Frans Vos - De wet van de edelste
Sinds mensenheugenis zijn ze in ons midden: Edelen van verschillende rang en stand. Afhankelijk van hun rangorde in de lijst der edelheid zijn ze al dan niet een knieval, ja soms zelfs onbaatzuchtige opofferingsbereidheid verschuldigd aan zij die hoger in de ranglijst figureren.
Door Frans Vos - Materials Consult BV
Wie welke positie in de lijst der edelheid mag bekleden, is afhankelijk van de omgeving waarin we ons begeven. Bevinden we ons in een land dat grenst aan zeeën of oceanen, dan wel in een land dat met zoete waterstromen en/of zompige, zure moerassen heeft te maken? Bovendien heeft de ene zee wat meer zoutgehalte dan de andere en bevat de ene waterstroom meer en/of andere verontreinigingen dan de andere. En wat zijn de stromingssnelheden en temperaturen in die respectieve omgevingen? Samen met nog andere parameters, zijn het allemaal factoren die de rangorde in de lijst der edelheid bepalen. De lijst der edelheid waarover we hier spreken is niet die van de adel, maar die van de edele en minder edele metalen. Door menigeen wordt deze lijst ook bestempeld als ‘de galvanische reeks’. Die reeks die - om het voorbeeld der voorbeelden te geven – zegt dat je in een watervoerend leidingensysteem een koperen flens niet in rechtstreeks, elektrisch geleidend contact met een stalen flens mag brengen ‘omdat anders het staal dreigt weg te corroderen’. Nu, eigenlijk hoort daar wel enige nuancering bij, want over welk staal gaat het hier? Over een ongelegeerd staal of over een roestvast staal? En gaat het in dat laatste geval dan over een austenitisch, een duplex of nog een ander type roestvast staal? En wat is dan de samenstelling van dat water? Gaat dat over leidingen die drinkwater van de watermaatschappijen vervoeren of betreft het putwater, zeewater enzoverder? En welke temperatuur en snelheid heeft dat water? In wezen kan er dus niet over ‘de’ galvanische reeks worden gesproken, maar moet er over galvanische ‘reeksen’ worden gesproken, in meervoud dus. Bij wijze van voorbeeld geven we hierbij een galvanische reeks geldig voor – een voor labowerk gestandaardiseerde – zeewatersamenstelling, voor het temperatuurbereik van 10 tot 30°C, en waarbij de witte balkjes gelden voor stromend water met een snelheid van 2 tot 4 meter per seconde en de zwarte balkjes gelden voor stilstaand water.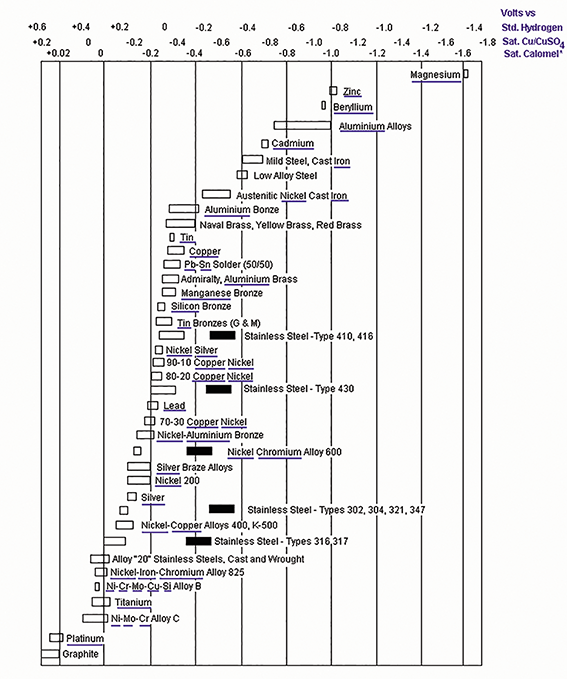
Galvanische reeks in zeewater.
Wat wordt er dan concreet in een dergelijke galvanische reeks weergegeven? In de eerste plaats zijn dat zogenaamde ‘potentiaalwaarden’ die een bepaalde, in het betreffende milieu ondergedompelde metaallegering vertoont van zodra het zijn chemische evenwichtstoestand in dat milieu heeft bereikt. Het betreft een elektrische potentiaal over het grensvlak tussen het metaaloppervlak en het water. ‘Elektrische potentiaal’ is daarbij terminologie die gangbaar is in de wereld van het corrosieonderzoek, maar is in wezen gewoon een elektrische spanningsval over het grensvlak, vergelijkbaar met de spanningsval die over de twee zijden van een elektrische condensator staat. Binnen een welbepaald milieu (dus binnen een welbepaalde galvanische reeks) is deze potentiaal uniek voor iedere metaallegering en kan er dus een volgorde van de evenwichtspotentialen van de metaallegeringen worden gemaakt. Als we dan nog een nulpunt vastleggen, kunnen er dan ook kwantitatieve waarden aan die potentialen worden toegekend. Concreet ziet u bovenaan deze galvanische reeks drie numerieke schalen, met elk een ander nul-referentiepunt. De bovenste schaal is de oorspronkelijke bij corrosieanalyses gebruikte ‘waterstofschaal’, die echter niet meer gangbaar is omwille van de inherente veiligheidsrisico’s als er waterstof in een labo wordt gebruikt. De andere twee schalen zijn respectievelijk de zogenaamde koper-kopersulfaat-schaal en de Calomel-schaal. Hoe hoger de potentiaal (hoe meer naar links) hoe edeler het metaal en hoe lager de potentiaal (hoe meer naar rechts) hoe onedeler het metaal.

Opofferingsanodes op een scheepsromp en -roer. © Materials Consult.
Vanuit die edel-onedel vergelijking laat de galvanische reeks dan onder andere toe om - binnen de gegeven randvoorwaarden van het milieu - te bepalen welke van twee metaallegeringen uit de reeks het hoogste risico op corrosie vertoont als je die twee metaallegeringen met elkaar in elektrisch geleidend contact brengt. Kijkend naar de galvanische reeks in zeewater bij 10 tot 30°C: Het riedeltje dat zegt dat je ‘in een watervoerend leidingensysteem een koperen flens niet in rechtstreeks, elektrische geleidend contact met een stalen flens mag brengen omdat anders het staal dreigt weg te corroderen’ lijkt daarbij inderdaad te gelden voor ongelegeerde en laaggelegeerde staalsoorten (‘mild steel’ en ‘low alloy steel’). Echter, voor roestvast staal (stainless steel) ten opzichte van koper, is dat allesbehalve zeker. Als we naar de witte balkjes kijken, vertonen de martensitische roestvast stalen 410 en 416 een edelheid die grotendeels gelijkaardig is als deze van koper en geeft deze galvanische reeks dus geen duidelijkheid over of het koper dan wel het roestvast staal het hoogste corrosierisico vertoont. Kijken we naar de austenitische roestvast stalen 302, 304, 321, 347, 316, 316, dan is het riedeltje ons blaasjes aan het wijs maken. In zeewater tussen 10 en 30°C bij stromingssnelheden van 2 tot 4 meter per seconde zal bij elektrisch metaal-metaal contact tussen koper en austenitisch roestvast staal het roestvast staal zich het edelste gaan gedragen en is het met andere woorden het koper dat het hoogste risico op corrosie vertoont.
Laat u dus niet indoctrineren door dergelijke riedeltjes die al menigeen op het verkeerde been hebben gezet. Om het nog wat complexer te maken: Wat als het stilstaand zeewater, dus de zwarte balkjes betreft? Het is duidelijk dat de verhoudingen en dus de corrosierisico’s dan veranderen. De condities in bewegend water zijn niet hetzelfde als in stilstaand water. Als u de waterstroming in leidingen stopzet voor een onderhoud zonder dat u de leidingen leeg laat lopen, kan er bij het gebruik van verschillende metalen in hetzelfde leidingensysteem dus een verlegging van het corrosierisico van de ene metaallegering naar de andere optreden. Voorgaande principes gelden ook bij het ‘opofferingsprincipe’, waarbij doelbewust twee metalen in elektrisch geleidend contact worden gebracht en het minst edele metaal zich corrosief ‘opoffert’ om het meer edele metaal te beschermen. Zo worden bijvoorbeeld op vele stalen structuren zinkanodes aangebracht om het onderliggende staal te beschermen. Denken we maar aan de corrosiepreventie voor stalen supportstructuren of de bescherming van stalen scheepsrompen en -roeren. De primaire corrosiebescherming wordt daarbij veelal geboden door een organisch coatingsysteem (waar op zich meestal ook al een galvanische opofferingsbescherming in verscholen zit door middel van zinkschilfers in de primerlaag), maar indien het coatingsysteem lokaal zou falen, staan er ook opofferingsanodes met de stalen scheepsromp in contact om waar nodig de corrosiebescherming te ondersteunen. Ook in dat opofferingsprincipe geldt trouwens dat de sterkte van de bescherming door onder andere de stromingssnelheid wordt beïnvloed. De zeeën en oceanen bevaren of in de haven stilliggen maakt dus ook een verschil.
Een ander riedeltje dat vaak opduikt in het kader van het opofferingsprincipe is dat, toegepast op de voormelde zink-staal combinatie, ‘eerst al het zink zich opoffert alvorens het staal wordt aangetast’. Om dat te verduidelijken hierbij eerst nog wat terminologie: Als zink zich opoffert om staal te beschermen, is het zink de ‘anode’ en het staal de ‘kathode’. Het riedeltje dat ‘eerst al het zink…’ houdt daarbij verband met een ander riedeltje, namelijk: ‘Hoe groter de anodische oppervlakte ten opzichte van de kathodische oppervlakte , hoe beter’ of ‘… hoe langer de bescherming’. Zoals bij vele van die riedeltjes, worden ze echter door de praktijk ontkracht. Als je een stalen balk neemt die alzijdig is verzinkt en er ontstaat een kras in de zinklaag waarbij de krasdiepte reikt tot aan het staaloppervlak, dan zal het zink aan de kras zich in een vochtige omgeving inderdaad beginnen opofferen om het blootgestelde staaloppervlak te beschermen. In de praktijk is het dan echter niet zo dat al dat zink op die balk eerst gaat verdwijnen alvorens het staal wordt aangetast. In werkelijkheid beschermt het zich opofferende zink het staal slechts over enkele millimeters ten opzichte van het via de kras blootgestelde staaloppervlak, of met andere woorden, indien het blootgestelde staaloppervlak groter wordt naarmate het zink zich opoffert, zal vanaf een bepaald ogenblik het centrum van het blootgestelde staaloppervlak niet meer beschermd zijn omdat het zink ‘te veraf’ is. Wanneer dat ‘bepaald ogenblik’ concreet begint, is afhankelijk van vele parameters, zoals onder andere het reeds voormelde milieu, de temperatuur, de stromingssnelheid, de chemische samenstelling van het staal, eventuele aanwezigheid van zwerfstromen enzoverder.

Selectieve uitloging van een messinglegering – microstructuur. © Materials Consult.
Zoals in voorgaande al werd gesuggereerd bij de verwijzing naar ‘potentialen’, is er bij metaalcorrosie ook sprake van een elektriciteitscomponent. Als er metaalcorrosie optreedt is er, naast de potentiaalverschillen, ook sprake van een elektronenstroom van de anode naar de kathode. Bij een galvanisch koppel is dat dan van de minst edele naar de meer edele en bij het zink-staal koppel dus van het zink naar het staal. De relatie tussen de potentiaalverschillen en die elektronenstroom wordt, zoals de wet van Ohm aangeeft, mee bepaald door de weerstand die de elektronenstroom ondervindt, en de daarmee samenhangende stroomdichtheden. Vergelijk het met een elektrisch koperdraadje waarvan de weerstand mee wordt bepaald door de dikte - eigenlijk de oppervlakte van de doorsnede - van dat elektrisch draadje. Als we een dunner koperdraadje van dezelfde lengte nemen, zal de weerstand van en de stroomdichtheid doorheen het draadje toenemen. Of terugkoppelend naar het zink dat zich aan het opofferen is om het staal te beschermen: Naarmate het zink zich opoffert, veranderen de oppervlakteverhoudingen en dus ook de stroomdichtheden in die zone. De riedeltjes ‘dat eerst al het zink…’ en ‘hoe groter de anodische oppervlakte ten opzichte van de kathodische…’ houden echter geen rekening met die lokale verandering in stroomdichtheden, waardoor die riedeltjes in heel wat gevallen de bal mis slaan.
De hiervoor beschreven corrosierisico’s verbonden aan galvanische koppelingen gelden trouwens niet alleen als de anode en de kathode twee fysiek duidelijk te onderscheiden technische componenten zijn, zoals de twee zijden van een flenskoppeling of een opofferingsanode op een stalen oppervlak. Zij kunnen zich ook op microscopisch niveau afspelen. Die specifieke vorm van galvanische corrosie wordt dan aangeduid met de term ‘selectieve uitloging’. Binnen de microstructuur van een metaallegering is er daarbij dan veelal sprake van een minder edele fase die uitloogt ten opzichte van de meer edele fase(n). Zo bevatten grijze gietijzerlegeringen grafiet, dat veel edeler is dan het ijzer, waardoor er bij contact met water het risico ontstaat dat het ijzer aan de oppervlaktezones wordt uitgeloogd, i.e. in het water wordt opgelost. Voor een dergelijk praktijkvoorbeeld kan je deze Materials blog consulteren: Uit de praktijk - Scheuren van een afsluiterbehuizing‘. Een ander voorbeeld van selectieve uitloging betreft duplex roestvaststaal legeringen, die zowel een ferritische als een austenitische fase bevatten. In vele omstandigheden is de ferritische fase daarbij minder edel dan de austenitische fase en is het dus de ferritische fase die wegcorrodeert, maar er zijn evenzeer omstandigheden mogelijk waarbij de austentische fase zich als de minst edele gedraagt. Nog een ander voorbeeld betreft messing. Dat zijn legeringen van koper met zink als het belangrijkste legeringselement. Sommige messingsoorten bevatten een zinkrijke en een zinkarme fase, waarbij de zinkrijke fase zich als minst edele zal gedragen en zal uitlogen. Er bestaan echter ook éénfasige messingsoorten. Kunnen die dan niet uitlogen? Toch wel, een selectieve uitloging kan immers niet alleen optreden omwille van een verschil in edelheid tussen metaalfasen, maar ook tussen chemische elementen. Zink is quasi steeds minder edel dan koper. Als een messinglegering wit uitslaat, betekent dat in vele gevallen dat selectieve uitloging heeft toegeslagen.

Scheurvorming gietijzeren afsluiterhuis © Materials Consult.
En zijn de galvanische reeksen dan voldoende om de risico’s op galvanische corrosie in een bepaald milieu, bij een bepaalde temperatuur en bij bepaalde stromingssnelheden in te schatten? Zijn zij voldoende om na te gaan of en welke opofferingsanodes we kunnen toepassen? Het is alleszins een goede start, maar zoals hiervoor reeds werd gesuggereerd, spelen ook andere factoren een rol. De invloed van oppervlakteverhoudingen en stroomdichtheden werd in voorgaande reeds geduid, maar is het u ook opgevallen dat bij de interpretatie van de onderlinge edelheid van metaallegeringen specifiek wordt uitgegaan van “metaal-metaal” contacten? In vele gangbare omstandigheden zijn roestvast stalen en aluminiumlegeringen echter ‘gepassiveerd’, waarbij zich op het metaal een afschermende (hydr)oxidehuid heeft gevormd en er dus eigenlijk geen sprake is van een ‘metaal’-‘metaal’ contact. In wezen is bij passiverende legeringen enkel sprake van een metaal-metaal contact als de passivatielaag geheel of gedeeltelijk zou verdwijnen. Om bij de beoordeling van corrosierisico’s dat passiverend vermogen mee in beschouwing te kunnen nemen, is er dus meer nodig dan de galvanische reeksen alleen. Zogenaamde ‘Pourbaix’ diagrammen, ook wel ‘E-pH’ diagrammen genaamd, zijn daarbij een eerste extra hulpmiddel. Als je daar meer over te weten wil komen, kan ik je alvast het artikel ‘De kunst van het passief overleven’ aanbevelen. En als je potentialen en elektrische stromen wil meten om meer over de corrosierisico’s voor jouw installaties en technische componenten te weten te komen, kan je ook voor zogenaamde polarisatiemetingen opteren. Daarvoor moet je je dan weer verdiepen in het ‘drie-elektroden principe’, dat niet alleen wordt gebruikt om polarisatiemetingen uit te voeren, maar ook om corrosieprocessen te monitoren – bijvoorbeeld om de effectiviteit van opofferingsanoden op te volgen – en om corrosiepreventie door middel van opgedrukte stroom te bekomen. Dat drie-elektroden principe lijkt me een interessant onderwerp om in één van de volgende ALURVS-magazines op terug te komen, maar uiteraard bent u ook nu al van harte welkom bij Materials Consult als u daar meer inzicht in wenst te bekomen. De wet van de edelste, maar welk metaal is dat dan? Uit voorgaande blijkt duidelijk dat dat niet zo eenvoudig te bepalen is als dat de in de wandelgangen circulerende riedeltjes suggereren. Heel wat van dergelijke technische riedeltjes zijn, afhankelijk van de omstandigheden, dus eerder als roddeltjes te kwalificeren. En wie laat zich door roddels leiden?




