Roestvast staal in contact met andere metalen (Deel 1)
Door complexe ontwerpen kan de mogelijkheid ontstaan om verschillende metalen te combineren binnen eenzelfde component. Ook kunnen dikwijls verschillende combinaties gevonden worden, enkel bepaald door de beschikbaarheid van, bijv. bevestigingsmaterialen of plaatjes. In bepaalde omstandigheden, kan zo’n ontwerp met gemengde materialen, leiden tot corrosie in één van de materialen. Dit fenomeen, veroorzaakt door een slechte combinatie van materialen, wordt galvanische corrosie1 genoemd, waarbij twee verschillende metalen een galvanisch koppel vormen.
Vertaald en aangepast van ARLT, N. / BURKERT, A. / ISECKE, B., Edelstahl Rostfrei in Kontakt mit anderen Werkstoffen (Merkblatt 829), Düsseldorf, Informationsstelle Edelstahl Rostfrei, vierde uitgave 2005 - Vertaling: Johan Dedeene, CLUSTA, Gent (B) in samenwerking met Wigo Huis in ’t Veld, Nijkerk, (NL) Bron: Euro Inox, Brussel (B)
(klik hier voor deel 2)
(Klik hier voor deel 3)
Door de vorming van galvanische elementen kan een versnelde corrosie van het minder edele materiaal voorkomen. Dit kan gepaard gaan met een veel hogere corrosiesnelheid dan wat men kan verwachten als er geen contact is met het edelere metaal. Corrosie gerelateerde schade zoals onaanvaardbaar uiterlijk aanzien, lekkende buizen of falende bevestigingsmiddelen kunnen de levensduur van een component drastisch verminderen en aanleiding geven tot vroegtijdige vervanging. Bij de meeste technische toepassingen heeft roestvast staal de meer positieve corrosiepotentiaal van de metalen die met elkaar in contact komen, zodat er gewoonlijk een gevaar voor corrosie is bij het materiaal waarmee het in contact komt. Het gevaar dat er galvanische corrosie optreedt hangt af van zeer veel factoren. Naast de gebruikte materialen zijn omgeving en ontwerp cruciaal. Het is daarom moeilijk om een rangvolgorde aan te geven bij de uitwisselbaarheid van de materialen. Deze publicatie beschrijft de principes van corrosie door galvanische cellen en de hoofdparameters die ontwerpers gebruiken om het corrosierisico te bepalen.
1Versnelde corrosie van een metaal, veroorzaakt door het effect van een corrosie element. Ook andere factoren zoals concentratie, beluchting en de verhouding actief/passief spelen een rol.
De principes van galvanische corrosie
Vooraleer galvanische corrosie optreedt, moet(en) er:
• verschillende corrosie potentialen zijn van de metalen in het gegeven systeem;
• een elektrisch geleidende verbinding tussen de twee metalen bestaan
• een vochtige elektrische geleider (elektrolyt) zijn die beide metalen verbindt
Figuur 1 toont de drie zaken die noodzakelijk zijn in grafiekvorm. Als galvanische corrosie aan de orde is, dan wordt het minder edele materiaal – de anode – bij voorkeur aangevallen, terwijl het edeler materiaal – de kathode – zelfs beschermd is tegen corrosie.
Eigenlijk is het principe van kathodische bescherming gebaseerd op opofferingsanodes die zorgen voor bescherming tegen corrosie. Het contact tussen twee metalen met verschillende potentialen met een oplos- sing die elektrisch geleidend is, zorgt voor een elek- tronenstroom van anode naar kathode. De elektrochemische reacties zijn dezelfde als die op natuurlijke wijze voorkomen in het geïsoleerde metaal. Hoe dan ook is de corrosie op de anode bijzonder versneld. In sommige gevallen kan de vorming van galvanische elementen leiden tot corrosie bij materialen die anders resistent zijn aan corrosie in de omgeving in kwestie. Dit kan het geval zijn voor passieve materialen zoals aluminium, die lokaal polariseren in een bepaalde omgeving. In zulke gevallen kan men locale corrosiefenomenen waarnemen, zoals spleet- of putcorrosie (pitting), die niet zouden zijn voorgekomen zonder de verandering in potentiaal bij de vorming van galvanische elementen. In tegenstelling tot wat meestal gedacht wordt, is het verschil in potentiaal in een elektrochemische cel alleen, geen goede indicator van het actuele risico op galvanische corrosie. Het geeft enkele een indicatie van het feit of er een risico bestaat. In deze context moeten ook de vele gepubliceerde tabellen met standaardpotentialen van metalen bekeken worden. Ze geven enkel de verschillende potentialen indicatief weer. De beslissende factor is niet het verschil in potentiaal geobserveerd onder standaard experimentele voorwaarden maar eerder het actuele verschil in potentiaal bij de werkelijke voorwaarden waarin de cel werkt. Daarom zijn er empirische tabellen van galvanische reeksen geproduceerd voor verschillende omgevingen zoals zeewater. Deze plaatsen de potentiaal van ver- schillende metalen binnen een gegeven omgeving (Figuur 2). Het besef van de noodzakelijke voorwaarden voor galvanische corrosie en het goed begrijpen van de voorbeelden in Figuur 3 maakt het mogelijk om preventieve acties te nemen zoals beschreven in sectie 6.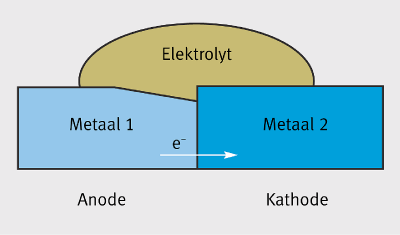
Figuur 1: Nodige voorwaarden voor galvanische corrosie.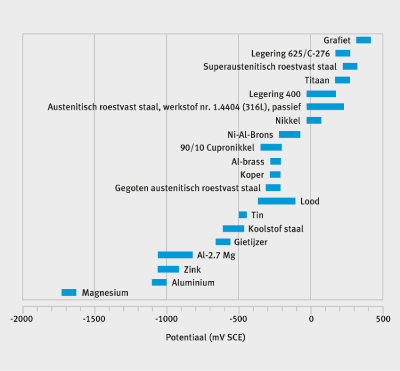
Figuur 2: De Galvanische Reeksen in zeewater bij 10 °C [11].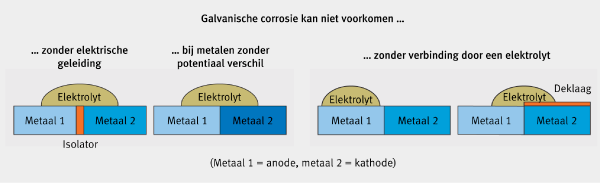
Figuur 3: Situaties waarbij galvanische corrosie niet kan voorkomen.
Relevante factoren en voorbeelden
Volgens de wet van Faraday zijn elektrochemische corrosieprocessen gerelateerd met transfer van ladingen – het vloeien van stromen. Stromen of stroomdichtheid worden daarom zeer veel gebruikt om corrosie te meten. Als aan de voorwaarden voor galvanische corrosie in principe voldaan is, dan is de totale corrosiestroom Itot samengesteld uit een deelstroom van de eigen corrosie Ieigen (bijv. het deel van de corrosie dat onafhankelijk is van het contact met andere materialen) en een deel stroom van de cel Iel (bijv. het deel van de corrosie veroorzaakt door de stroom tussen de partnermaterialen onderling) (vergelijking 1).
Itot = Ieigen + Iel (Vergelijking 1)
De intensiteit van het corrosie element wordt bepaald door het verschil in potentiaal tussen de twee metalen (∆U), de weerstand van de elektrolyt (Rel) en de polarisatieweerstand aan de anode (Rp,a) en de kathode
(Rp,k) respectievelijk (vergelijking 2).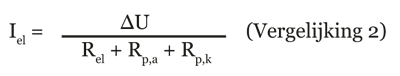
Uit deze vergelijking, kunnen conclusies getrokken worden over de factoren die aanleiding geven tot galvanische corrosie. Deze factoren zijn kritisch bij het vaststellen of de metallische corrosie al dan niet een technisch relevant probleem wordt. De effecten van deze factoren worden daarom individueel besproken.
1 Weerstand van de elektrolyt
Het gevaar op galvanische corrosie vermindert met een toenemende weerstand van de elektrolyt. Dit is omdat het bereik van de galvanische stroom is verminderd en de verandering van potentiaal aan de anode gelimiteerd is, zoals geïllustreerd in Figuur 4. Meten van de potentiaal aan de oppervlakte identificeert, in geval van een geïsoleerde anode, de plaats van de respectievelijke potentialen van de kathode en anode, onafhankelijk van elkaar. In de overgangszone, wordt er een duidelijke potentiaalsprong waargenomen. Als er een elektrisch geleidende verbinding tussen kathode en anode bestaat, dan wordt een kleine polarisatie van de anode naar hogere waarden waargenomen bij elektrolyten met een hoge weerstand (zoals gecondenseerd water). Als de elektrolyt een lage weerstand heeft (zeewater), dan wordt er een zeer sterke polarisatie gemeten. Hoe hoger de polarisatie, hoe hoger de corrosiesnelheid van de anode als het materiaal actief is, of hoe meer waarschijnlijk de kritische (corrosiestartende) potentiaal passief is. Tabel 1 toont de specifieke geleidbaarheids waarden van ve schillende types water.
2 Bevochtigingstijd en omgeving
Er is een sterke interactie tussen de weerstand van de elektrolyt en de bevochtigingstijd. Dit is kritisch wanneer de componenten niet permanent nat zijn door waterige oplossingen. Zoals in de beschrijving van de voorwaarden voor galvanische corrosie is uitgelegd, speelt de elektrolytfilm een sleutelrol. Zonder een dergelijke film kan er geen galvanische corrosie plaatsvinden. Dit houdt, praktisch gezien, in dat niet elke combinatie van metalen kritisch bekeken moet worden op het gebied van corrosie als er geen elektrolyt aanwezig is. Dit is typisch voor interieurs waarin geen condensatie voorkomt. Bij verlichtingselementen of bij decoratieve componenten in het interieur, kan eigenlijk elke materiaalcombinatie gebruikt worden, in normale beluchte en verwarmde omgevingen, zonder beperkingen door een corrosierisico (Figuur 5). Zowel de blootstellingsduur als de weerstand van de elektrolyt zijn sterk afhankelijk van lokale omstandigheden. In zee-, industriële of binnenzwembad-milieus is de waarschijnlijkheid dat er galvanische corrosie optreed hoger dan bij de omstandigheden in landelijke omgevingen. 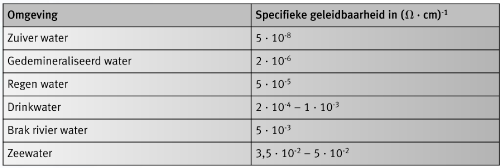
Tabel 1: Typische waarden van specifieke geleidbaarheid bij verschillende soorten water.
Figuur 5: Omdat er geen elektrolyten zijn in normaal verwarmde en geventileerde binnentoepassingen, zal de combinatie van roestvast staal met andere metalen, zoals geschilderd koolstofstaal normaliter geen risico geven op galvanische corrosie in dergelijke omstandigheden.
Figuur 6 toont de invloed van het milieu op de corrosiesnelheid van zink, al dan niet in contact met roestvast staal. Het toont het deel corrosie aan ten gevolge
van de cel (bijv. het verschil tussen de corrosiesnelheden) en dat van de eigencorrosie (bijv. de corrosiesnelheid van zink zonder in contact te komen met roestvast staal) in een kustatmosfeer en in een zeew ter spatzone.
Naast omgevingsatmosfeer, spelen ook ontwerpdetails een beslissende rol. Factoren die helpen om een vochtige film snel te laten opdrogen (adequate beluchting, voorkomen van spleten, drainage van regenwater) verminderen de corrosiesnelheid. Voortdurend vochtige plaatsen in spleten of bedekte plaatsen, stilstaand water en bevuilde oppervlakten kunnen galvanische corrosie versnellen.
3 Kinetica van de elektrode reacties
De kinetica van de reacties aan de elektrode worden uitgedrukt in vergelijking 3 door waarden van de polarisatie weerstand van de anode en de kathode. Verschillen in potentiaal lager dan 100 mV kunnen tot corrosie leiden, terwijl metalen met merkbaar hogere verschillen in potentiaal zonder moeilijkheden met elkaar verbonden kunnen worden. In feite geven verschillen in potentiaal geen informatie over de kinetica van de galvanische corrosie. De kinetica van de reactie hangt af van het metaal. Titaan, bijv. vermindert de opgeloste zuurstof veel minder snel dan koper. Dit verklaart waarom koolstofstaal veel eerder corrodeert in contact met koper dan met titaan, ondanks dat titaan een hoger positieve potentiaal heeft dan koper. In deze context, speelt ook de vorming van corrosielagen een beslissende rol. Deze kunnen de potentiaal van een materiaal significant veranderen en een obstakel vormen voor de anode en/of kathode deelreactie.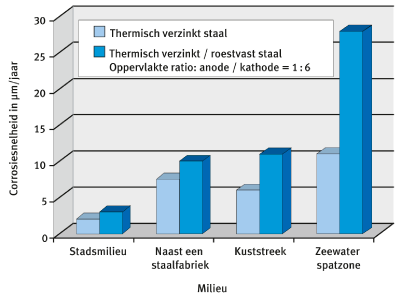
Figuur 6: Corrosie snelheden van thermisch verzinkt staal, met en zonder contact met roestvast staal, in verschillende milieus.
4 Kathode en anode oppervlakken
Een factor in de berekening van de stroomdichtheid van de cel, Iel (oppervlaktegerelateerde celstroom) is de verhouding van kathodische (Ok) en anodische (Oa) oppervlakten. Het beïnvloedt sterk de snelheid van de galvanische corrosie (Vergelijking 3).
Zolang het oppervlak van de kathode (het meest edele metaal van het galvanisch koppel) zeer klein is in vergelijking tot de oppervlakte van de anode (het minst edele metaal) is er geen verandering in het gedrag van
de corrosie waargenomen. Deze situatie wordt getoond in Figuur 7.
Typische voorbeelden kunnen gevonden worden wanneer roestvast stalen bevestigingsmiddelen gebruikt worden op aluminium of gegalvaniseerde stalen componenten. Twee praktische toepassingen worden getoond in Figuur 8. Zelfs in corrosieve omgevingen, veroorzaakt dit materiaal geen zichtbare galvanische corrosie. Onder atmosferische condities is het soms moeilijk om de actieve delen van de anode en de kathode oppervlakken te bepalen. Voor een praktische evaluatie mag dit, alhoewel het niet noodzakelijk is. Normaal is het voldoende om het systeem in het alge-meen te beschouwen. Bij combinaties van materialen, worden bevestigingsmaterialen altijd gemaakt van het meer edeler materiaal, indien de kathode oppervlakte klein is. Het tegenovergestelde daarentegen kan een probleem geven. Indien een kleine anode omgeven wordt door een grote kathode, kan galvanische corrosie optreden, zoals getoond in Figuur 9.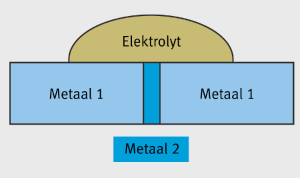
Figuur 7: Als de kathode (metaal 2) klein is in vergelijking met de anode (metaal 1) wordt er geen schade veroorzaakt.
Figuur 8a, 8b: Praktische toepassingen van de principes getoond in Figuur 6: gegalvaniseerd staal in contact met roestvast staal in een kust omgeving.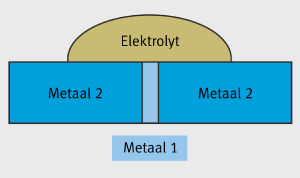
Figuur 9: Galvanische corrosie veroorzaakt door een grotere kathode (metaal 2).
Typische voorbeelden van zo’n situatie worden getoond in Figuur 10. Bij deze gevallen is het duidelijk dat, bij corrosieve omstandigheden, het partner metaal versnelde corrosie ondergaat.
Figuur 10a, 10b: Praktische voorbeelden van het principe getoond in Figuur 9 (verzinkt staal in contact met roestvast staal, in een zee atmosfeer).
Figuur 11: Om galvanische corrosie te voorkomen, zouden enkel roestvast stalen bevestigingsmaterialen gebruikt mogen worden bij roestvast stalen panelen.
(klik hier voor deel 2)
(klik hier voor deel 3)



