Corrosie in waterige milieus Deel 1
Corrosie in niet-gesloten watersystemen
In dit eerste deel komen de factoren aan de orde welke van invloed zijn op het corrosiegedrag van metalen en legeringen. Voorbeelden zijn: de pH-waarde, het chloridegehalte, de aanwezigheid van micro-organismen, de temperatuur, de stroomsnelheid, de legeringssamenstelling van het materiaal en de oppervlaktegesteldheid van het materiaal.
J.J.M. Hesselmans
Een theoretisch model waarmee in de praktijk zeer goed te werken is, is het volgende:
Corrosie is een elektrochemisch proces wat veroorzaakt wordt door een elektrisch potentiaalverschil tussen twee metalen of door variatie in microstructuur of milieu aan het oppervlak van een metaal. Het gedeelte met de laagste potentiaal wordt de anode genoemd, Hoe groter het potentiaalverschil tussen de anode en kathode, hoe sneller het proces zal verlopen. Bij de anode vinden de anodische reacties plaats, dit zijn de reacties welke het metaal doen oplossen. Afbeelding 1 toont een principeschets van corrosie van staal. Bij de kathode vinden de kathodische reacties plaats, de meest voorkomende zijn:
1. reductie van waterstofionen volgens: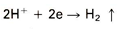
Hoe hoger de concentratie H+-ionen (dus hoe lager de pH-waarde), hoe gemakkelijker deze reactie verloopt. M.a.w., in een zuur milieu verloopt deze reactie het gemakkelijkst. In neutrale milieus vinden voornamelijk andere kathodische reacties plaats zoals:
2. Reductie van water: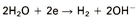
Deze reactie geeft aan dat in water in principe altijd een kathodische reactie plaats kan vinden. Desalniettemin verloopt deze reactie moeizaam wat dus inhoudt dat bij gebrek aan andere componenten voor kathodische reacties het corrosieproces langzaam zal verlopen (afhankelijk van de mate van geleidbaarheid van het water). Als het water een hoog zuurstofgehalte bevat en licht zuur is, dan zal gemakkelijker de volgende reactie plaatsvinden:
3. Reductie van zuurstof: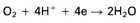
Als neutraal water veel zuurstof bevat, dan overheerst de volgende kathodische reactie:
4. zuurstofreductie van water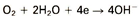
Tot slot kunnen nog drie minder voorkomende kathodische reacties worden genoemd:
5. Reductie van ijzer 3+ ionen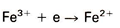
Dit komt voornamelijk voor onder sterk zure turbulente omstandigheden, bijvoorbeeld bij het reinigen van vaten met zuren. Onder bepaalde omstandigheden kan het corrosieproces dan zeer snel verlopen [zie de schadeanalyse van A. Glas: 'Ferro-ferri-fini'; Corrosie, januari 1988].
6. Reductie van sulfaationen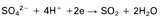
Sulfaationen kunnen ook door bacteriën worden gereduceerd naar waterstofsulfide. Deze reactie (en andere kathodische reacties waarbij micro-organismen zijn betrokken) kunnen in verontreinigd water als afvalwater plaatsvinden.
7. Reductie van metaalionen, in dit geval koper: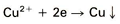
Treedt op bij aanwezigheid van edelere metaalionen, b.v. neerslag van koper op ijzer. Als de anodische of de kathodische reactie niet plaats kan vinden, dan stopt het corrosieproces. Vandaar dat kennis van de bovenstaande kathodische reacties bij corrosiebestrijding van nut kan zijn. De meest voorkomende kathodische reacties zijn de reacties 1 t/m 4. Verhoging van de pH-waarde (dus vermindering van het aantal H+ -ionen) en verlaging van het zuurstofgehalte vertragen het corrosieproces. Ten aanzien van een laag zuurstofgehalte is in geval van bepaalde toepassingen overigens waakzaamheid geboden, wat uit het verdere verloop van dit artikel zal blijken. Negatief geladen ionen worden aangetrokken door de positief geladen metaalionen bij de anode, positief geladen ionen worden aangetrokken door de kathode. Op deze wijze vormt zich bij corrosie van staal aan de anode ijzerllhydroxide eri ijzerlllhydroxide. Dehydrolyse van deze produkten (onttrekking van water waardoor ijzeroxiden en gehydrateerde ijzeroxiden ontstaan) leidt tot de vorming van het bekende roodbruine roest. Afhankelijk van aantal factoren waarvan de legeringssamenstelling de belangrijkste is, vormen de corrosieprodukten een al dan niet af sluitende, beschermende laag op het oppervlak. Duidelijk zal zijn dat indien een dergelijke laag wordt gevormd het corrosieproces zeer sterk wordt vertraagd.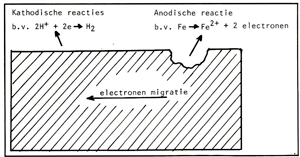
Afb. 1 Principeschets van het corrosiemechanisme van staal.
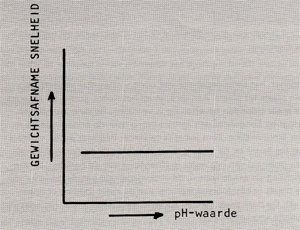
Afb. 2 Invloed van de pH-waarde op het corrosiegedrag van edele metalen.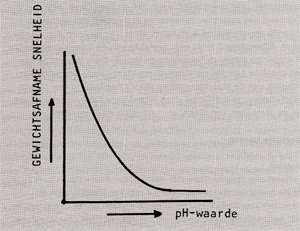
Afb. 3 Invloed van de pH-waarde op het corrosiegedrag van metalen waarvan het corrosieprodukt in een zuur milieu oplost.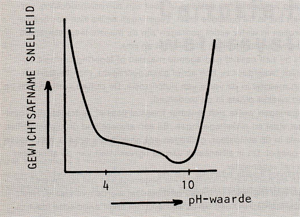
Afb. 4 Invloed van de pH-waarde op het corrosiegedrag van ijzer- en staallegeringen.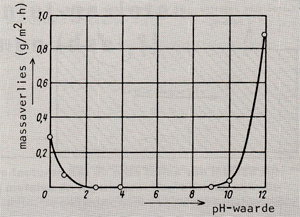
Afb. 5 Invloed van de pH-waarde op de oplosbaarheid van het oxidelaagje op aluminium.
Actief-passief
Als een metaal of legering corrodeert, verkeert het in de actieve staat. Als een metaal of legering wordt beschermd door een kunstzeer sterk wordt vertraagd. matig aangebrachte deklaag of door zijn corrosieprodukten, verkeert het in de passieve staat. Legeringen welke zich normaalgesproken in water actief gedragen zijn de meeste laaggelegeerde staaltypen en gietijzer, aluminium en zink. Als bij zich passief gedragende metalen of legering corrosie optreedt (waardoor ze zich actief gaan gedragen), manifesteert dit zich meestal in de vorm van putcorrosie. De putten vormen zich op een zwakke plaats in de oxidehuid. Legeringen welke zich in w.ater meestal passief gedragen zijn roestvast staal en nikkellegeringen. Bij een afwisselend droog/nat milieu zoals in de atmosfeer, gedragen ook aluminium en zink zich meestal passief. Dit is afhankelijk van de agressiviteit van de atmosfeer en het regenwater. Aan de hand van bovenstaande gegevens kan het corrosie-effect van veel ingrepen in milieu of materiaal worden verklaard. Heeft deze ingreep invloed op de kathodische en/of anodische reacties, dan zal het corrosieproces veranderen. Worden de anodische reacties afgeremd of gestopt, dan wordt dit anodische polarisatie genoemd. Een voorbeeld van anodische polarisatie is de vorming van het beschermende oxidelaagje op b.v. roestvast staal. Worden de kathodische reacties afgeremd of gestopt, dan wordt dit kathodische polarisatie genoemd. Een voorbeeld hiervan is verhoging van de pH-waarde. Er zijn ook stoffen welke corrosie bevorderen of afremmen zonder rechtstreeks aan de kathodische of anodische reacties deel te nemen. Een voorbeeld van een stof welke corrosie bevordert is het chloride-ion, een voorbeeld van stoffen welke corrosie vertragen zonder aan de reacties deel te nemen zijn chromaten en nitrieten. Onderstaand komt een aantal factoren aan de orde welke van invloed zijn op het corrosiegedrag van metalen en legeringen in watermilieus:
Het milieu
pH-waarde
Uit het voorgaande is al gebleken dat de pH-waarde grote invloed heeft op corrosieprocessen, twee kathodische reacties worden immers bepaald door de concentratie H+·ionen (de pH-waarde is de negatieve logarithme van de concentratie H+ -ionen dus hoe lager deze waarde, hoe hoger de concentratie H+ -ionen). Het effect van de pH-waarde op het corrosiegedrag is afhankelijk van het metaalof legeringstype. Zo is de pH-waarde niet van invloed op edele metalen (afb. 2). Vaak wordt de corrosiesnelheid bij een bepaalde pHwaarde bepaald door de oplosbaarheid van het oxide in het medium. De corrosiesnelheid-pH-waarde curve van een oxide wat in een zuur milieu oplost, ziet er dan uit als in afb. 3 is weergegeven. Indien het oxide in een basisch milieu oplost, vormt zich een grafiek welke het spiegelbeeld van de curve van afb. 3 is. Wat ijzer betreft, is de corrosiesnelheid tussen pH 4,3 en pH 10,0 laag en vrij constant (afb. 4). Dit komt doordat de pH-waarde van de vloeistoffilm onmiddellijk aan het oppervlak licht basisch blijft vanwege verzadiging van de film met het alkaliserende ijzerhydroxide. Het gevormde corrosieprodukt werkt in dit geval dus als een inhibitor. In dit gebied heeft vooral zuurstof invloed op het corrosieproces (kathodische reacties 3 en 4). Als laatste kunnen nog de metalen worden genoemd die zogenaamde amphoterische oxiden vormen. Hierbij lossen de oxiden in zowel een zuur als in een basisch milieu op. Voorbeelden hiervan zijn aluminium en zink, afb. 5 toont de pHwaarde tegen de corrosiesnelheid van aluminium. Ook zink toont een dergelijk corrosiegedrag. Op het putcorrosiegedrag van een zich passief gedragende legering heeft de pH-waarde rechtstreekse invloed. Verlaging van de pHwaarde verhoogt de gevoeligheid voor putcorrosie. Afb. 6 toont een principeschets van de invloed van de pH-waarde op het putcorrosiegedrag van een legering. Stapsgewijs verlagen van de pH waarde kan een plotselinge doorslag van de beschermende oxidehuid teweeg brengen, waardoor putcorrosie op gaat treden. Wordt hierna de pH-waarde weer opgevoerd, dan zal het corrosieproces pas bij een hogere waarde stoppen dan de pH-waarde waarbij het is begonnen, het oxidehuidje moet zich immers onder moeilijke omstandigheden herstellen.
De pH-waarde van oppervlaktewater varieert normaalgesproken tussen pH 6 en pH 7,5. Regenwater kan plaatselijk pH-waarden tot beneden pH 4 bereiken. De pH-waarde van zeewater is ongeveer pH 8.
Chloriden
Chloriden doen niet mee aan de anodische of kathodische reacties, toch hebben ze vaak een grote invloed op het corrosieproces. Hiervoor kunnen de volgende oorzaken worden gegeven:
- 1. Bevordering van de oplosbaarheid van metaalionen door vorming van complexe ionen zoals bij koper CuCI 3-.
- 2. Kathalytische werking op de anodische reactie.
- 3. Verhoging van de geleidbaarheid van het milieu.
Het bovenstaande geldt in mindere mate voor andere halogeenionen als fluoride, bromide en jodide. Daarnaast komen deze ionen minder voor in water waardoor ze verder buiten beschouwing zullen worden gelaten. Vooral op zich passief gedragende legeringen hebben chloriden een sterk negatieve invloed. Gevreesd zijn chloriden bij toepassing van roestvast staal. Vaak wordt bij toepassing van een bepaalde rvs-legering een maximaal chloridegehalte gegeven. Deze waarde kan echter niet zonder meer worden toegepast omdat de corrosiviteit niet alleen afhankelijk is van het chloridegehalte. Ook de pH-waarde, het zuurstofgehalte, de stroomsnelheid, de temperatuur, de aanwezigheid van inhibiterende ionen als OH-, CLO3-, CrO42- en NO3- hebben invloed op de corrosiviteit van chloriden. Van belang is ook de oppervlaktegesteldheid van de legering. Echter, uitgaande van een goede oppervlakteafwerking met een goede passieve oxidelaag, een verder neutrale wateroplossing en afwezigheid van neerslag of vaste deeltjes op het oppervlak, kan worden gesteld dat het maximale chloridegehalte voor toepassing van rvs AISI 304 (DIN 1.4301) ongeveer 300 mg/liter is en voor toepassing van AISI 316 (DIN 1.4401) ongeveer 1.000 mg/liter is.
Een slechte kwaliteit rvs oppervlak (b.v. na lassen zonder schermgas en niet beitsen en passiveren) zal al bij een chloridegehalte van enkele mg!liter corroderen. Een optimaal afgewerkt AISI 316 oppervlak kan onder bepaalde omstandigheden zonder problemen voor toepassingen in zeewater worden gebruikt. Het chloridegehalte van leidingwater varieert tussen de 30 en 100 mg/liter. Het chloridegehalte van oppervlaktewater varieert sterk van plaats tot plaats. Aan de kust zal het sloot-, grond- en rivierwater meer chloriden bevatten t.g .v. verzilting. Bij riviermondingen dringt bij hoogwater een zgn. zouttong over de bodem van de rivier landinwaarts. Zout water is zwaarder dan zoet water, vandaar dat het water bij de bodem meer chloriden zal bevatten. De mate van brakheid van het water is afhankelijk van de getijden, de windrichting en windsnelheid, de stroomsnelheid van de rivier en van de plaats in het doorsnedeprofiel van de rivier (bodem of oppervlak). Op deze wijze kunnen soms flinke uitschieters in het chloridegehalte voorkomen. Het chloridegehalte van zeewater bedraagt ruim 20.000 mg/liter. Het chloridegehalte van afvalwater is afhankelijk van het type afvalwater. Ook de atmosfeer en regenwater geven chloriden af aan het oppervlaktewater, met name in de buurt van de kust. Deze chloriden zijn afkomstig van zeewater, vanwaar ze in de vorm van aerosolen (chloride aan miniscuul waterdruppeltje) met de lucht zijn meegevoerd. Afbeelding 7 toont een overzicht van de chlorideneerslag in de winter en zomer in Nederland en België. Deze informatie kan niet absoluut worden gerelateerd aan corrosiviteit omdat de vermenging van de chlorideneerslag sterk afhankelijk is van de omstandigheden. Wel blijkt uit deze afbeeldingen dat de corrosiviteit van de atmosfeer per plaats en jaargetijde sterk verschilt.
Opgeloste gassen
Zuurstof
In vrijwel alle oppervlaktewater, drinkwater, koelwater, etc. is zuurstof de motor achter de kathodische reacties (reactie 3 en 4). M.a.w. het zuurstofgehalte heeft grote invloed op de corrosiesnelheid. Indien de zuurstof verdwijnt, zal vaak ook het corrosieproces stoppen. Hiervan wordt in geval van gesloten systemen dankbaar gebruik gemaakt door aan het water zuurstofbinders toe te voegen. Denk hierbij aan de centrale verwarming, waar zelfs al zonder toevoegmiddelen de corrosie na enige tijd sterk vertraagt doordat de zuurstof tijdens het corrosieproces wordt opgebruikt. Beïnvloeden van het zuurstofgehalte van het water is bij open systemen meestal onmogelijk. Soms kan men het zuurstofgehalte van water in een open systeem enigszins beïnvloeden. Zo kan het moment waarop de temperatuur in een systeem wordt verhoogd worden vervroegd (temperatuursverhoging betekent daling van het zuurstofgehalte). Bij inname van oppervlaktewater wordt een lager zuurstofgehalte bereikt door het innamepunt op grotere diepte te plaatsen. Turbulentie in transportleidingen moet zoveel mogelijk worden vermeden. Plaatselijke verschillen in zuurstofgehalte (beluchtingsverschillen) kunnen desastreus zijn.
Bij spleetcorrosie speelt het zuurstofgehalte een grote rol. De motor achter deze corrosievorm is vaak het verschil tussen het zuurstofgehalte in de spleet en dat erbuiten. Hierdoor ontstaat een galvanische cel welke de anodische reacties in de spleet plaats laat vinden en de kathodische reacties buiten de spleet. Ook onder vaste deeltjes op het oppervlak (als zand) kan een beluchtingsverschil plaatsvinden waardoor lokaal anodes (onder het deeltje) en kathodes (rondom het deeltje) ontstaan.
Voor zich passief gedragende metalen wijkt de invloed van zuurstof op het corrosiegedrag in principe niet af t.o.v. de invloed bij andere metalen en legeringen. Ook hier zou bij afwezigheid van zuurstof corrosie niet plaatsvinden, als er tenminste geen andere stoffen zijn die de rol van zuurstof als veroorzaker van de kathodische reactie kunnen overnemen. Zijn deze wel aanwezig (wat vrijwel altijd het geval is), dan is een laag zuurstofgehalte ongunstig omdat het beschermende oxidelaagje niet kan worden gevormd of in stand kan worden gehouden waardoor de passiviteit verdwijnt. Om deze reden kan rvs AISI 316 alleen in stromend zeewater (voldoende toevoer zuurstof voor instandhouding van de oxidelaag) worden toegepast.
Andere gassen
Koolstofdioxide verzuurt liet water t .g.v. vorming van carbonzuur. Normaal gesproken is deze verzuring niet noemenswaardig, echter in bepaalde gevallen kunnen micro-organismen als bacteriën de concentratie CO2 verhogen. Ook waterstofsulfide werkt verzurend. Daarnaast vormt het met ijzer ijzersulfide, wat een corrosieve stof voor staallegeringen is. Waterstofsulfide wordt door sulfaat reducerende bacteriën gevormd. De corrosiviteit van chloorgas zit voornamelijk in het feit dat het chloor zich omzet tot chloride.
T.g.v. de kathodische reactie (1) of (2) ontstaat waterstof aan het metaaloppervlak. Zolang deze waterstof in atomaire vorm is kan het in het metaal diffunderen en bij bepaalde sterkere (dus brossere) legeringen waterstofbrosheid veroorzaken. Waterstofbrosheid ontstaat t.g.v. opeenhoping van waterstofgas in holten in de legering. T.g.v. een enorme drukverhoging aldaar treedt scheurvorming op.
Metaalionen
Als het metaalion edeler is dan het corroderende metaal, dan kan de kathodische reactie (7) plaatsvinden. Daarom zijn koperionen corrosief voor staal en ijzerionen corrosief voor aluminium. Daarentegen zijn magnesium, calcium, of natriumionen niet corrosief voor staal omdat ze onedeler zijn dan ijzer. Vaak werken deze ionen zelfs inhibiterend. Koperionen kunnen bijvoorbeeld voorkomen t.g .v. corroderende koperen of messing onderdelen. Ook kunnen ze afkomstig zijn van bepaalde bevestigingsmaterialen of van koperhoudende chemicaliën.
Micro-organismen
Algen
Algen produceren zuurstof en zijn op die wijze verantwoordelijk voor een verhoging van het zuurstofgehalte. Algen kunnen zich alleen ontwikkelen bij aanwezigheid van voldoende licht.
Bacteriën
Onder vrijwel alle omstandigheden kunnen bacteriën in water voorkomen; bij lage en hoge temperatuur, bij aanwezigheid en afwezigheid van zuurstof, in stromend en stilstaand water, met en zonder zonlicht enz. Bacteriën kunnen plaatselijke aantastingen veroorzaken. Op deze wijze kan ook in koolstofstaal, wat normaalgesproken vrij uniform corrodeert, ernstige putcorrosie ontstaan. Om verschillende redenen zijn vele bacteriën corrosief voor de meeste legeringen. Al genoemd zijn de sulfaat reducerende bacteriën (Desulfovibrio desulfuricans) welke waterstofsulfide vormen. Ook agressief zijn de zwaveloxiderende bacteriën (Thiobaccilus) welke zwavelzuur vormen (wat een sterke verzuring teweeg brengt). Onderzoek heeft uitgewezen dat op deze wijze de pH-waarde plaatselijk kan dalen tot pH-1. Een belangrijke groep bacteriën welke corrosie kunnen veroorzaken zijn de veel voorkomende aerobe bacteriën. Deze vormen koolstofdioxide wat een verzuring van het milieu teweegbrengt. De meeste aerobe bacteriën zijn daarnaast ook verantwoordelijk voor de vorming van een slijmlaag op het metaaloppervlak. Deze slijmlaag is vaak agressief omdat ze de produkten van de bacteriën vasthoudt (het C02 en soms organische zuren) en omdat vreemde, eventueel agressieve, deeltjes zich gemakkelijk op de slijmlaag hechten. De aerobe bacteriën zijn ook verantwoordelijk voor beluchtingsverschillen aan het oppervlak. Voor koper en zijn legeringen kunnen nog de bacteriën genoemd worden welke NH3 vormen. Deze verbinding kan hierbij selectieve aantasting en spanningscorrosie veroorzaken. Tot slot kan nog worden. opgemerkt dat vele bacteriën naast het produceren van agressieve stoffen ook nog verantwoordelijk kunnen zijn voor het laten plaatsvinden van kathodische reacties. Genoemd is al de reductie van sulfaationen naar waterstofsulfide. Vaak worden drinkwaterleidingen of procesleidingen in de voedingsmiddelenindustrie gedesinfecteerd met chloor of met natriumof calciumhypocriet Van dit sterk oxiderende en chloridevormende desinfectiemiddel kan nog worden opgemerkt dat het bij verkeerd gebruik bijzonder corrosief kan zijn, ook voor een corrosiebestendig materiaal als rvs AISI 316. Bij het ontsmetten van een leidingsysteem, b.v. in de zuivelindustrie of een drinkwaterleiding, is het van groot belang dat onmiddellijk na het ontsmetten de leidingen grondig worden gespoeld. Afb. 8 toont een voorbeeld van aantasting door natriumhypochloriet van rvs AISI 316.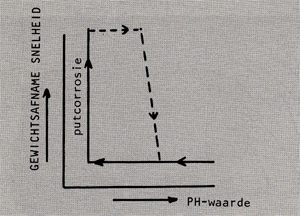
Afb. 6 Invloed van de pH-waarde op het putcorrosiegedrag van een zich passief gedragende legering. In combinatie met agressieve ionen als b.v. chloriden wordt bij verlaging van de ph waarde een potentiaal bereikt waarbij putcorrosie plotseling op gaat treden. Wordt de pH-waarde dan weer verhoogd, dan zal het oppervlak zich pas weer bij een aanzienlijk hogere pH-waarde herstellen.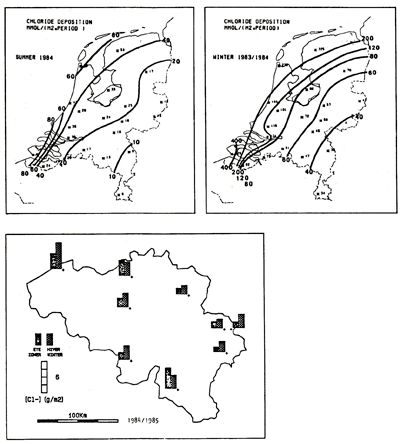
Afb. 7 Overzicht van de chlorideneerslag in de zomer en in de winter in Nederland en in België. Ontleend aan gegevens van het Landelijk Meetnet Regenwatersamenstelling KNMI/RIVM (Nederland) en Regennet 1984-1985, A. Meurrens, Instituut voor Hygiëne en Epidemiologie, Brussel (België).
Fysische invloeden
Stroomsnelheid
Om meerdere redenen heeft de stroomsnelheid invloed op het corrosiegedrag van metalen en legeringen. In sommige gevallen is deze invloed gunstig, in andere gevallen ongunstig. Algemeen kan worden gesteld dat hoge, turbulente stroomsnelheden ongunstig zijn vanwege de erosieve werking. Dit geldt met name als in het water vaste deeltjes als zand zitten. Op deze wijze ontstaat een combinatie van erosie en corrosie, afhankelijk van de mate van deze componenten erosie-corrosie of corrosie erosie genoemd. Bij zich actief gedragende legeringen is stroming normaal gesproken ongunstig omdat hierdoor versnelde aan en afvoer van de aan de corrosiereactie deelnemende componenten plaatsvindt. Toch moet worden opgemerkt dat ook stilstaand water ongunstig kan zijn als dit de groei van micro-organismen bevordert of als hierdoor zich een agressieve neerslag op het oppervlak kan vormen. Bij zich passief gedragende legeringen is stilstaand water vaak ongunstig omdat t.g.v. bezinksel het zuurstofgehalte aan het oppervlak te laag kan worden waardoor het oxidehuidje zich niet in stand kan houden. Voor roestvast staal wordt regelmatig een minimum stroomsnelheid vereist, deze is afhankelijk van het gevaar op het eventueel bezinken van slib en andere vaste deeltjes.
Temperatuur
Verhoging van de temperatuur betekent verhoging van reactiesnelheden dus ook toename van de corrosiesnelheid. In uitzonderlijke gevallen kan een temperatuursverhoging de corrosiesnelheid echter remmen. Een voorbeeld is als de corrosie veroorzaakt wordt door een hoog zuurstofgehalte. Door stijging van de temperatuur verdwijnt een groot gedeelte van het zuurstof waardoor de corrosiesnelheid afneemt t.g.v. gebrek aan voldoende zuurstof.
Het materiaal
Naast het milieu zijn natuurlijk de kwaliteit van het materiaal en een eventuele beschermlaag van grote invloed op het corrosiegedrag. Bij materiaalkeuze voor toepassingen in water wordt gekozen voor een corrosiebestendig materiaal (in dit geval metaal of legering) of voor een onvoldoende corrosiebestendig materiaal wat dan door een coatingsysteem wordt beschermd. Bij coatingsystemen is het van groot belang dat een coating wordt gebruikt welke geschikt is voor de toepassing. De mogelijkheden zijn te talrijk om in dit bestek te behandelen. Net zo belangrijk als de juiste coatingkeuze is dat het systeem op de voorgeschreven wijze wordt aangebracht, waarbij de kwaliteit van het metaaloppervlak doorslaggevend is. Als een coating het door een mechanische of chemische oorzaak plaatselijk heeft begeven, dan vindt het corrosieproces weer plaats als boven is beschreven, in veel gevallen zal het t.g.v. spleetvorming zelfs versneld plaatsvinden. Bij niet beschermde metalen en legeringen spelen de microstructuur en de oppervlaktekwaliteit een grote rol. Hierbij kan bij zich actief gedragende legeringen de nadruk worden gelegd op de microstructuur en bij zich passief gedragende legeringen de nadruk worden gelegd op de oppervlaktegesteldheid.
Legeringssamenstelling en microstructuur
Vanuit oogpunt van corrosiebestendigheid is een gelijkmatige microstructuur ideaal. Alle andere fasen dan de basisfase kunnen aanleiding geven tot galvanische corrosie t.g.v. een potentiaalverschil tussen de beide fasen. Het ongunstigste is het als de fase met het geringste volume onedeler is dan de basisfase. Bij staal en gietijzer kan de microstructuur grote invloed hebben op het corrosiegedrag. Vooral vorming van overmatig mangaansulfide bevordert de corrosiesnelheid in het algemeen en de gevoeligheid voor putcorrosie in het bijzonder. Afb. 9 toont een mooi voorbeeld waarbij te zien is dat corrosie selectief op deze fase aantast. Een te hoog mangaan en/of zwavelgehalte zijn vanuit corrosieoogpunt ongunstig. Vanuit het oogpunt van mechanische eigenschappen is een hoger mangaangehalte juist gunstig, wat constructeurs soms tot concessies t.a.v. corrosiegedrag dwingt. Er zijn ook legeringselementen welke de corrosiebestendigheid van staal en gietijzer enigszins verhogen. Voorbeelden zijn silicium, chroom en nikkel. Bekend is ook het zgn. Cor-Ten staal. Dit is een staaltype waaraan geringe hoeveelheden chroom (0,5%), Nikkel (0,6%) en koper (0,4%) zijn toegevoegd. Naast een hoge sterkte bezit dit staaltype een uitstekende corrosiebestendigheid tegen een afwisselend droog/nat milieu. Vanwege deze eigenschappen wordt het toegepast voor bruggen, torens en andere toepassingen in de buiten-atmosfeer. De corrosiebestendigheid is te danken aan de vorming van een hecht afsluitend oranjekleurig roestlaagje. Bij permanente toepassing onder water wijkt het corrosiegedrag van deze legering niet veel af van het corrosiegedrag van de gebruikelijke staallegerihgen.
Een ander voorbeeld van de invloed van de legeringssamenstelling (en daarmee ook de microstructuur) op het corrosiegedrag is het legeren van aluminium met koper. Aluminium-koper legeringen zijn ontwikkeld vanwege de uitstekende sterkte-eigenschappen. In de matrix bevinden zich aluminium-koper verbindingen welke een hogere potentiaal bezitten dan het omliggende zuivere aluminium. Op deze wijze ontstaan bij contact met een geleidende vloeistof op microschaal galvanische cellen welke weer aanleiding geven tot putcorrosie. Dergelijke legeringen zijn voor toepassing in oppervlakte-, drink- of afvalwater ongeschikt. Dit geldt ook voor de aluminiumzink, koper legeringen. Wat aluminiumlegeringen betreft zijn zuiver aluminium en aluminium- mangaan legeringen het best bestand tegen corrosie. Deze bieden voldoende weerstand tegen niet te agressieve watermilieus. Ook van de meest voorkomende aluminiumlegeringen als aluminium- magnesium en aluminium-magnesium-silicium legeringen is de corrosiebestendigheid redelijk tot goed. In het algemeen geldt dat aluminiumlegeringen welke permanent onder water worden toegepast moeten worden geanodiseerd. Koper en zijn legeringen zijn goed bestand tegen de meeste watermilieus. Het minst corrosiebestendig is het huis-tuin en keuken messing. Echter geringe toevoegingen aan dit messing (b.v. arsenicum of tin) verhogen de corrosiebestendigheid aanzienlijk. Ook tegen stilstaand of langzaam stromend zeewater is koper redelijk bestand. Voor contact met snelstromend zeewater zijn koper en de meeste koperlegeringen minder geschikt. Uitzonderingen vormen aluminiummessing, koper-aluminium legeringen en koper-nikkel legeringen. Bij de legeringen 'naval brass' en 'admirality brass' verwijst de naam al naar de toepassing. Dit zijn twee messinglegeringen waaraan ter verbetering van de corrosiebestendigheid nikkel is toegevoegd. Ook bekend is de zeer corrosiebestendige koper-nikkel legering (eigenlijk nikkel-koper legering) monel, een legering met 30% koper, 4% andere legeringselementen, rest nikkel. Koper kan niet goed tegen oxiderende milieus. Dit in tegenstelling tot b.v. roestvast staal, waar een oxiderend milieu het beschermende oxidelaagje in stand houdt.
Afb. 8 Putcorrosie ontstaan t.g.v. het onjuist gebruik van natriumhypochloriet. Een AISI 316L drinkwaterleiding was na behandeling met dit desinfecterende middel onvoldoende gespoeld waardoor putcorrosie binnen twee dagen ontstond. Deze afbeelding toont de doorsnede van een put. Vergroting: 50x.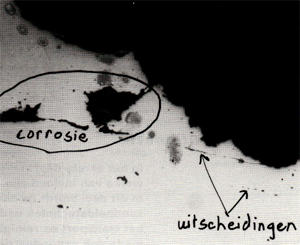
Afb. 9 Corrosie welke ontstaat op uitscheidingen in koolstofstaal. Op deze wijze kan de corrosiesnelheid aanzienlijk toenemen t.o.v. een metallisch zuiverder staaltype. Doorsnede over aangetaste pijpwand, vergroting 200x.
Oppervlaktegesteldheid
Een ruw oppervlak betekent in feite dat er zich aan het oppervlak ontelbare spleetjes bevinden. Spleetcorrosie op microschaal is dus de eerste verklaring voor het bevorderen van corrosie t.g.v. een ruw oppervlak. Een tweede verklaring is de aanwezigheid van verhoogde inwendige spanningen aan het ruwe oppervlak, de deformatiegraad van het oppervlak is immers hoger dan die van een glad afgewerkt oppervlak. Op plaatsen waar zich hoge inwendige spanningen bevinden ontstaan anodische gebieden terwijl die plaatsen met lagere spanningen zich kathodisch zullen gedragen. Op deze wijze wordt de corrosiesnelheid verhoogd. Duidelijk significante invloed op het corrosiegedrag heeft de oppervlaktegesteldheid van zich passief gedragende metalen en legeringen. De kwaliteit van het oppervlak is equivalent met de kwaliteit van het beschermende oxidelaagje. T.g.v. krassen, lasspetters, temperatuurverhoging, vreemde deeltjes op het oppervlak, enz., kan het corrosiegedrag sterk worden beïnvloed. Bekend is b.v. dat een hoge temperatuur de kwaliteit van een oxidehuid kan verminderen. Vandaar dat gebruik van schermgassen en/of herstellen van de oxidehuid door een chemische oppervlaktebehandeling bij b.v. lassen van groot belang zijn.



