Lokale corrosievormen: putcorrosie: Deel 1 en 2
Deel 1 en 2
1. Inleiding
Lokale corrosiemechanismen die zich afspelen bij passiveerbare metalen, waarbij roestvast staal de eerste plaats inneemt, bepalen in hoge mate de grenzen waarbinnen ze kunnen worden gebruikt in milieus waar uniforme corrosie nihil is als gevolg van de beschermende passieve laag. Lokale corrosie gaat gepaard met een anodische oplosreactie die zich beperkt tot een klein deel van het metaaloppervlak, terwijl de rest van het metaaloppervlak beschermd blijft door een passieve laag. Er treedt dus een lokale doorbraak op van de beschermende laag en als daar geen herstel plaatsvindt ontwikkelt zich een situatie die in het uiterste geval leidt tot perforatie van het metalen object.
Het optreden van lokale corrosie is technologisch een veel groter probleem dan gelijkmatige aantasting. Het probleem waarvoor lokale corrosie ons stelt kan worden opgesplitst in de volgende vier punten:
1. Het verschijnsel is veel minder voorspelbaar door het grote aantal variabelen dat een rol kan spelen.
2. De aantastingssnelheid is over het algemeen niet of veel minder nauwkeurig te schatten doordat ook de snelheid sterk afhankelijk is van een groot aantal factoren.
3. Bij lokale corrosievormen moet rekening worden gehouden met een initiatietijd voordat het corrosieproces op gang komt.
4. Het inspecteren van installaties op lokale corrosievormen is niet eenvoudig. De corrosieschade bevindt zich vaak grotendeels onder het metaaloppervlak waarbij slechts een minimale opening aan het oppervlak voor het oog zichtbaar is. Daarnaast kan de opening aan het oppervlak zijn afgedekt met corrosieproduct dat moeilijk te onderscheiden is van bijvoorbeeld oppervlakkige roestvorming. Hierdoor komt lokale corrosie bij visuele inspecties niet altijd tijdig aan het licht. Bovendien zijn veel plaatsen in installaties slecht toegankelijk voor een zeer nauwkeurige visuele inspectie.
De vier bovenstaande punten geven al aan dat er niet kan worden volstaan met een eenvoudige vuistregel aan de hand waarvan in elke situatie een betrouwbare materiaalkeuze kan worden gemaakt. Handboeken geven vaak niet meer dan de indicatie dat er een risico bestaat ten aanzien van lokale corrosie. Het is van belang de lokale corrosievormen die zich voordoen in bestaande situaties te identificeren en bedacht te zijn op corrosievormen die zich eventueel voor kunnen doen in nieuw te vervaardigen constructies. Met dit doel voor ogen zal de uiterlijke verschijning van lokale corrosievormen worden beschreven. Roestvaststaaltypen die gevoelig zijn voor specifieke lokale corrosievormen worden besproken, evenals de milieuzijdige omstandigheden waaronder lokale corrosie zich voordoet. Het exacte corrosiemechanisme is natuurlijk als eerste aan de orde.
2. Putcorrosie
2.1 Het mechanisme
2.1.1 Initiatie
Putcorrosie vangt aan met het plaatselijk doorbreken van het passieve metaaloppervlak. Verondersteld wordt dat putcorrosie wordt geïnitieerd door de adsorptie van agressieve ionen op zwakke plaatsen in het passieve oppervlak waarbij door inwerking van de agressieve ionen een doorbraak ontstaat. Aan de putinitiatie gaat een periode vooraf waarin geen waarneembare corrosie optreedt. Deze periode wordt de incubatietijd genoemd en kan variëren van een enkele dag of nog korter tot jaren, afhankelijk van het betreffende milieu en het staaltype.
Agressieve ionen
Van de ionen die op deze manier putcorrosie van roestvast staal kunnen initiëren is chloride de bekendste. Andere ionen die eenzelfde uitwerking, zij het in mindere mate, op passieve oppervlakken kunnen hebben zijn Br-, F- en I-. Ook de aanwezigheid van waterstofsulfide (H2S) met zijn verschillende omzettingsproducten kan op soortgelijke wijze putcorrosie initiëren. Op de plaats van doorbraak is de passieve laag die het verloop van anodische reacties aanvankelijk verhinderde niet meer aanwezig. De anodische reacties kunnen ongeremd verlopen waardoor er plaatselijk een elektronenoverschot ontstaat en de potentiaal naar een negatievere waarde verschuift, namelijk naar de potentiaal die behoort bij de actieve toestand. Met het instellen van het verschil in potentiaal tussen het anodische en kathodische gebied ontstaat ook een netto-stroom tussen het anodische en kathodische gebied waarmee het overschot aan elektronen wordt afgevoerd. Dit vindt plaatst in het metaal door stroomgeleiding (ladingstransport door verplaatsing van elektronen). In de oplossing, die ontoegankelijk is voor losse elektronen, heeft het ladingstransport plaats door ionen. Als er geen netto-stroom zou gaan lopen dan neemt immers het overschot aan elektronen onbeperkt toe of de reacties kunnen bij het bereiken van een bepaalde grootte van het elektronenoverschot niet verder verlopen hetgeen betekent dat corrosie niet verder kan optreden. Dit is niet het geval.
Instabiliteit
In de initiatiefase is het voortbestaan van een corrosieput tamelijk onzeker. De concentratie chloride-ionen en de bij de doorbraak gevormde reactieproducten kunnen door stromingen in de waterige oplossing worden weggevoerd waarna het oppervlak door aanvoer van oxiderende stoffen (zuurstof) spontaan repassiveert. De putinitiatie voorziet immers nog niet in de afgeschermde holte die een verder uitgegroeide corrosieput uiteindelijk zal veroorzaken. Ook is het mogelijk dat de veroorzaker van de verzwakking in de passieve laag, bijvoorbeeld een insluitsel nabij het metaaloppervlak, door het initiatieproces wordt verwijderd waarna repassivering optreedt. Er is in de praktijk daadwerkelijk waargenomen dat nieuwe putinitiaties instabiel zijn en soms maar een korte periode actief zijn. De instabiliteit van putinitiaties onder invloed van stromingseffecten is deels verantwoordelijk voor het feit dat veel putcorrosieschade ontstaat gedurende stilstand van het medium.
2.1.2 Propagatie
Als de putinitiatie niet spontaan repassiveert zal ter plaatse van de doorbraak verdere aantasting optreden. De corrosiereacties die aan het anodische oppervlak verlopen veroorzaken condities die het verder uitgroeien van de corrosieput stimuleren. pH-veranderingen aan de anodische en kathodische gebieden In de meeste milieus zijn bij de kathodische reactie opgeloste zuurstof en H+-ionen betrokken (reactie 1 en 2). Doordat aan het kathodische oppervlak de kathodische reacties sterk overheersen zal hier een pH-verhoging optreden.
O2 + 2H2O + 4e —> 4OH- (1)
2H+ + 2e —> H2 (2)
Daarentegen ontstaat aan het anodische oppervlak een pH-verlaging. Een reactie die hier genoemd kan worden is de hydrolyse van de bij de oxidatiereactie gevormde metaalionen.
Fe2+ + H2O —> Fe(OH)+ + H+ (3)
Fe2+ + 2H2O —> Fe(OH)2 + 2H+ (4)
Cr3+ + 3H2O —> Cr(OH)3 + 3H+ (5)
De grootte van de werkelijke pH-veranderingen hangt af van de chemische samenstelling van de oplossing en de stromingscondities. Zo wordt verzuring van het milieu aan het anodische oppervlak afgezwakt door de bufferende werking (dit is het vermogen van een oplossing om haar pH constant te houden) van carbonaten, bicarbonaten en boraten die zich bijvoorbeeld in zeewater bevinden. Er kan echter met zekerheid gesteld worden dat als de kathodische en anodische gebieden duidelijk ruimtelijk zijn gescheiden er een aanzienlijk verschil in pH-waarde ontstaat. Dit is het geval bij putten, spleten en scheuren, maar ook in het geval van een anodisch gebied dat is afgeschermd door een kapje bestaande uit corrosieproducten. De verlaging van de pH resulteert in een plaatselijk corrosiever milieu in de corrosieput terwijl de verhoging van de pH aan het kathodische oppervlak de corrosiviteit vermindert.
Migratie van negatieve ionen
Het snel oplossen van metaalionen en de daarmee samenhangende verzuring veroorzaakt een opeenhoping van positieve ionen in de corrosieput. Dit resulteert in de migratie (dit is de beweging van ionen onder invloed van een elektrisch veld) van negatieve ionen naar de put waardoor het elektrisch evenwicht wordt hersteld. Negatieve ionen die zich dan naar de corrosieput verplaatsen zijn chloride-ionen, maar ook sulfaationen. De chloride-ionen verhogen de oplosbaarheid van metaalionen waardoor het in oplossing gaan van nieuwe ijzer- en chroomionen wordt bevorderd. De sulfaationen vormen in combinatie met H+- ionen zwavelzuur. Het zeer corrosieve milieu dat op deze wijze tijdens het verder uitgroeien van de corrosieput wordt gevormd, versnelt de aantasting en maakt het corrosieproces minder afhankelijk van de corrosiviteit van het milieu buiten de corrosieput. De oplosbaarheid van zuurstof is zeer beperkt in sterk geconcentreerde chlorideoplossingen waardoor de reductie van zuurstof (reactie 1) niet verloopt in de corrosieput. Als voorbeeld van de hierboven beschreven uitgroei van corrosieputten kan worden gedacht aan roestvast staal dat wordt blootgesteld aan een goed beluchte, neutrale oplossing van natriumchloride. De uiteindelijke situatie die dan in de corrosieput zal ontstaan is schematisch weergegeven op afbeelding 1.
Zwaartekracht
De richting waarin corrosieputten zich meestentijds uitbreiden is de richting waarin de zwaartekracht werkt. De meeste corrosieputten ontwikkelen zich op horizontale vlakken en groeien daarbij uit naar beneden. Het aantal corrosieputten dat zich op verticale wanden ontwikkelt is al aanzienlijk minder terwijl corrosieputten die zich op de onderzijde van een horizontaal vlak vormen vrij ongebruikelijk zijn. Twee verklaringen hiervoor zijn:
1. Het versneld doorgroeien van de corrosieput na initiatie wordt sterk bevorderd door het geconcentreerde corrosieve medium dat zich in de put vormt. Dit medium heeft een relatief grote dichtheid waardoor het juist op horizontale vlakken makkelijker gehandhaafd blijft. De stabiliteit van een beginnende corrosieput is hierdoor op een horizontaal vlak groter.
2. Afzettingslagen en bezinksel vormen zich gemakkelijker op horizontale vlakken. Het aldus van de bulk van de oplossing afgeschermde milieu kan plaatselijk aan veranderingen onderhevig zijn. Zo kan de aanvoer van zuurstof worden bemoeilijkt en kunnen hogere concentraties opgeloste ijzerionen en chroomionen aanwezig zijn. Hierdoor neemt de kans op putcorrosie onder de afschermende laag toe. Wanneer beschermende afzettingslagen of neerslagen op het oppervlak aanwezig zijn kunnen scheuren en andere defecten in deze lagen aanleiding geven tot het optreden van lokale corrosievormen. Een voorbeeld hiervan is de walshuid van staal, waarin scheuren kunnen ontstaan door de verschillen in thermische uitzetting van de walshuid en van het onderliggende staal. De scheuren vormen dan de anodische gebieden en de walshuid is het kathodische gebied.
Grootte van anodische en kathodische oppervlakken
Voor de snelheid waarmee beginnende putten uitgroeien tot forse corrosieputten en uiteindelijk tot perforaties is de verhouding tussen anodische en kathodische oppervlakken van wezenlijk belang. Voor het corrosieproces geldt dat de totale anodische stroom (IA) gelijk moet zijn aan de totale kathodische stroom (IK). Als we bij wijze van vereenvoudiging stellen dat aan het anodische oppervlak alleen anodische reacties verlopen en aan het kathodische oppervlak alleen kathodische reacties dan geldt:
IA = IK of iA . OA = iK . OK
Waarin: iA = anodische stroomdichtheid
OA = totaal anodisch oppervlak
iK = kathodische stroomdichtheid
OK = totaal kathodisch oppervlak
Uit bovenstaande formule is eenvoudig te herleiden dat als het anodische gebied zeer klein is en het kathodische oppervlak zeer groot de anodische stroomdichtheid groot zal zijn ten opzichte van de kathodische stroomdichtheid. Afbeelding 2 geeft hiervan een schematische weergave. Een grote anodische stroomdichtheid wil niets anders zeggen dan een hoge corrosiesnelheid en dus een snel verlopend groeiproces van de corrosieput(ten).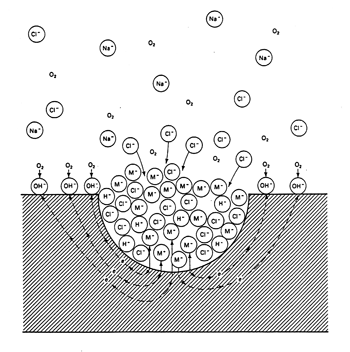
Afbeelding 1 S chematische weergave van de processen die verlopen in een corrosieput. Het metaal M wordt door putcorrosie aangetast in een beluchte NaCl-oplossing.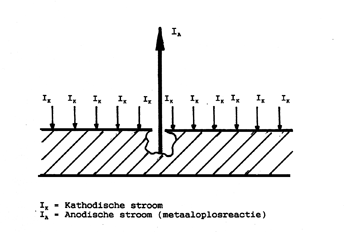
Afbeelding 2 S chematische weergave van de verdeling van anodische en kathodische stroom over het metaaloppervlak bij putcorrosie.
De elektrische geleidbaarheid van het corrosieve medium bepaalt de grootte van het kathodisch gebied dat nog van invloed is op de corrosiesnelheid van een enkele corrosieput. Een grotere geleidbaarheid vergroot het meewerkende oppervlak. Dit houdt in dat er een groter oppervlak is waar kathodische reacties kunnen verlopen zodat IK zal toenemen en dus moet ook IA toenemen omdat altijd moet gelden: IA = IK. Aangezien het anodisch oppervlak hetzelfde blijft moet dan iA toenemen; de anodische stroomdichtheid en dus de oplossnelheid in de put zal hoger zijn. In het geval er een groter aantal corrosieputten op een oppervlak aanwezig is, is het anodische oppervlak groter en zal de groeisnelheid van de afzonderlijke putten lager zijn. Samenvattend: een groot kathodisch oppervlak tegenover een klein anodisch oppervlak, zoals dat bij putcorrosie het geval is, is een ongunstige situatie die bijdraagt tot een hoge groeisnelheid van de corrosieput.



