Elektrochemische corrosie: fundamentele begrippen: Deel 5, Actief en passief corrosiegedrag
Tot hiertoe zijn, om de bespreking wat te simplificeren de effecten van de reacties die volgen op de anodische metaaloplosreactie buiten beschouwing gelaten. De vorming van beschermende oppervlaktelagen en neerslagen van corrosieproducten kan de anodische metaaloplosreactie bemoeilijken waardoor het corrosiegedrag en de corrosiepotentiaal drastisch worden beïnvloed. De verlaging van de corrosiesnelheid die het gevolg is van de vorming van oppervlaktelagen die de anodische reacties bemoeilijken staat bekend als passief corrosiegedrag. Voor metalen die passief gedrag vertonen kan de toevoeging van oxiderende stoffen aan een waterig milieu een verhoging van de corrosiepotentiaal tot gevolg hebben waarbij zich echter een passieve oppervlaktelaag vormt waardoor de corrosiesnelheid afneemt in plaats van toeneemt.
5.1 Passiviteit
Er zijn een aantal metalen die zich onder geschikte omstandigheden met een zeer dunne laag bedekken. Deze laag bestaat in de meeste gevallen uit een slecht oplosbare film van metaaloxiden. Dankzij de goede afsluitende eigenschappen, de goede hechting en de grote weerstand voor de doorgang van ionen en elektronen wordt de anodische metaaloplosreactie sterk geremd. De corrosiesnelheid van een metaal dat bedekt is met een dergelijke oxidelaag is veel lager dan op grond van de corrosiepotentiaal zou worden verwacht. Een dergelijk gedrag wordt passiviteit genoemd. Er kan gesproken worden over passiveerbare of passieve metalen. Voorbeelden van passiveerbare metalen zijn:
- ijzer - tin
- chroom - titanium
- nikkel - aluminium
Roestvast staal maakt, door legeren met het element chroom, gebruik van de passieve chroomoxidelaag die wordt gevormd op het roestvaststaaloppervlak. De corrosiesnelheid van roestvast staal is onder veel toepassingsomstandigheden vrijwel nihil omdat het roestvast staal zich in de passieve toestand bevindt. Een voorbeeld hiervan is roestvast staal dat wordt toegepast in de voedingsmiddelenindustrie. Hier mag geen noemenswaardige corrosie optreden in verband met productverontreiniging. De passiviteit van roestvast staal wordt beïnvloed door:
metaalzijdig
- de legeringssamenstelling van roestvast staal
- de aanwezigheid van uitscheidingen, insluitsels en andere afwijkingen in de microstructuur
- de oppervlakteafwerking van het roestvast staal milieuzijdig
- de samenstelling van het corrosieve milieu
- de temperatuur
- het oxiderend vermogen
- de pH-waarde
- de stromingssnelheid
De invloed van bovengenoemde factoren zal verder worden toegelicht aan de hand van een voor roestvast staal typische polarisatiecurve. Hiervoor is enige kennis van het begrip polarisatie en de polarisatiecurve noodzakelijk.
5.2 Polarisatiecurve
Als aan een systeem dat zich in een waterig milieu bevindt en aan zichzelf is overgelaten met behulp van een hulpelektrode en een uitwendige spanningsbron een positieve spanning wordt aangelegd, dan neemt de anodische deelreactie toe en de kathodische deelreactie wordt onderdrukt. Dit resulteert in een netto anodestroom Ianode. Zoiets kan ook worden gerealiseerd door metallisch geleidend koppelen met een edeler metaal. Door nu steeds een iets positievere spanning aan te leggen en de zich daarbij instellende stroom te meten en deze waarden in een grafiek uit te zetten ontstaat er een zogenaamde polarisatiecurve. Deze curve wordt ook wel aangeduid als E-i of E-log[i] -curve. Aangezien de waarde van de stroom die gaat lopen nogal kan oplopen, wordt om de grafiek overzichtelijk te houden vaak de logaritme van de stroom genomen, hetgeen een aanzienlijk gedempter beeld geeft en er treedt vanaf een bepaalde potentiaal een lineair verloop op. Meestal wordt in plaats van de stroom de stroomdichtheid genomen, omdat de stroom afhankelijk is van de afmetingen van het gebruikte proefstuk. De stroomdichtheid i wordt doorgaans uitgedrukt in ampère per cm2, dit is de gemeten stroomsterkte gedeeld door het oppervlak van het gebruikte proefstuk. Uit dit soort curven zijn gegevens af te lezen die informatie geven over het corrosiegedrag van het geteste metaal in het betreffende milieu. We beperken ons in deze cursus tot het bespreken van de polarisatiecurve van roestvast staal. Afbeelding 6 toont een schematische weergave van de anodische tak van de polarisatiecurve van roestvast staal die tot stand komt door geleidelijke verschuiving naar positievere potentiaal.
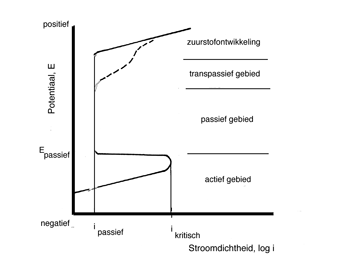
Afbeelding 6 Schematische weergave van de anodische tak van een voor roestvast staal gebruikelijke polarisatiecurve.
In de anodische tak van de curve zijn drie gebieden waarneembaar, namelijk:
Het actieve gebied
In het actieve gebied neemt bij verhoging van de potentiaal de stroomdichtheid steeds toe. Verhoging van de potentiaal in dit gebied resulteert in een verhoging van de corrosiesnelheid.
Het passieve gebied
Verder verhogen van de potentiaal geeft vanaf een bepaalde potentiaal een plotselinge drastische vermindering van de stroomdichtheid. Het metaaloppervlak is in de passieve toestand geraakt. De potentiaal die het begin van het passieve gebied kenmerkt wordt de passiveringspotentiaal genoemd.
Bij het verder verhogen van de potentiaal in het passieve gebied neemt de netto-stroomdoorgang niet of niet noemenswaardig toe. De maximale stroomdichtheid die voorafgaand aan de terugval wordt bereikt is een maat voor het gemak waarmee een legering passiveert in het betreffende milieu. Deze maximale stroomdichtheid wordt aangeduid als de kritische stroomdichtheid of kritische passiveringsstroomdichtheid (ikritisch). Bezit het milieu over voldoende oxiderend vermogen, dan zal het metaal vanzelf in de passieve toestand geraken. Is dit niet het geval dan kan het metaal in het betreffende milieu in de actieve of in de passieve toestand verkeren. Het metaal zal vanuit de actieve toestand zonder hulp van buitenaf niet passiveren. Hulp van buitenaf kan bestaan uit geforceerde beluchting of toevoeging van oxiderende stoffen. Vanuit de passieve toestand kan door langdurige inwerking van agressieve ionen zoals chloride of door mechanische beschadiging van de passieve laag wel een overgang naar het actieve gebied optreden. Als het milieu de kritische stroomdichtheid zelf niet op kan brengen spreken we van instabiele passiviteit.
Het transpassieve gebied
Bij het verder verhogen van de potentiaal neemt bij de overgang van het passieve naar het transpassieve gebied de stroomdichtheid duidelijk toe. De toename van de stroomdichtheid is het gevolg van geleidelijke oxidatie van het metaal tot een hogere oxidatietrap. Hierbij gaat de oxidelaag geleidelijk in oplossing. Een voorbeeld hiervan is het oxideren van driewaardig chroom (Cr3+) in Cr2O3 tot CrO4 2- waarin het chroom in de Cr6+ toestand verkeert. Ook is het mogelijk dat het passieve gebied doorloopt totdat de oxidatie van een component uit het waterige milieu een toename van de stroomdichtheid veroorzaakt. De reactie die in een waterig milieu gaat verlopen bij een dergelijk hoge positieve potentiaal is reactie 5 waarbij zuurstof wordt ontwikkeld. In dit geval is er geen sprake van transpassief corrosiegedrag. 4OH- → O2 + 2H2O + 4e (5), zie ook reactie 4
5.3 De legeringssamenstelling
Afbeelding 7 geeft aan hoe de verhoging van het gehalte aan legeringselementen de polarisatiecurve beïnvloedt. Het gaat hierbij alleen om de richting en niet om de grootte. De grootte van de verschuiving in de aangegeven richting wordt namelijk ook beïnvloed door het milieu. Er valt op dat chroom, molybdenium, nikkel en titanium de kritische stroomdichtheid verlagen. Dit wil zeggen dat de overgang van actief naar passief gedrag wordt vergemakkelijkt. Daarnaast is chroom in zeer belangrijke mate verantwoordelijk voor verlaging van de stroomdichtheid en dus van de corrosiesnelheid in het passieve gebied. Factoren die eveneens van invloed zijn op de stroomdoorgang in het passieve gebied zijn:
- oppervlakteruwheid (lagere ruwheid is gunstig);
- mechanische spanningen aan het metaaloppervlak (drukspanningen zijn gunstig);
- eventuele verrijking aan legeringselementen in de oppervlaktelaag, veroorzaakt door een passiveringsbehandeling of door elektrolytisch polijsten.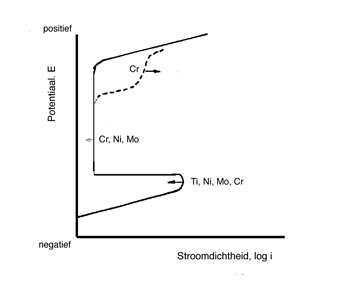
Afbeelding 7 Schematische weergave van de invloed van legeringselementen van roestvast staal op de anodische tak van de polarisatiecurve.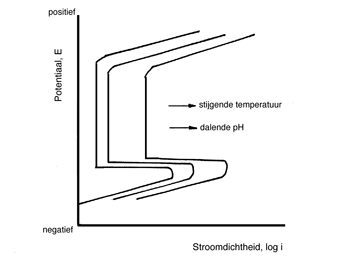
Afbeelding 8 Schematische weergave van de invloed van verhoging van de temperatuur en verlaging van de pH-waarde op de polarisatiecurve van roestvast staal.
5.4 De pH en temperatuur
Temperatuur
Temperatuurveranderingen zijn van invloed op de oplosbaarheid van vaste stoffen en gassen in het water. Verhoging van de temperatuur beïnvloedt de oplosbaarheid van zouten. Dit kan betekenen dat er meer zout kan worden opgelost, zoals voor keukenzout het geval is. Een andere mogelijkheid is dat zich juist een afzetting vormt op delen van verwarmingselementen. De oplosbaarheid van zuurstof neemt af bij verhoging van de temperatuur waardoor kathodische reacties waarvoor zuurstof nodig is worden geremd. De snelheid waarmee reacties verlopen neemt toe bij verhoging van de temperatuur. Dit verklaart de toename van de corrosiesnelheid die doorgaans het gevolg is van een temperatuurverhoging. Als indicatie: per 10˚C temperatuurverhoging verdubbelt de reactiesnelheid. Verhoging van de temperatuur kan ook tot gevolg hebben dat niet meer de reactiesnelheid maar de aanvoersnelheid van reactieproducten de snelheidsbepalende stap in het corrosieproces wordt. De invloed van de temperatuur op het verloop van kathodische reacties kan een andere richting en grootte hebben dan die op de anodische reacties. Hierdoor is er op voorhand geen goede voorspelling mogelijk van het gevolg van een temperatuurverandering voor het corrosieproces, en dus voor de snelheid waarmee een metaal wordt aangetast. Op grond van ervaring is voor een specifieke metaalmilieucombinatie vaak bekend wat het uiteindelijke effect van een temperatuurverandering is. Voor de pH gelden soortgelijke overwegingen die hier niet nader zullen worden genoemd. Als algemene regel kan worden aangehouden dat de verhoging van de temperatuur en verlaging van de pH-waarde de corrosiesnelheid doen toenemen. Afbeelding 8 toont schematisch hoe een toename van de temperatuur en een verlaging van de pH van invloed zijn op de polarisatiecurve van roestvast staal. Wat opvalt is dat bij verhoging van de temperatuur en verlaging van de pH de kritische stroomdichtheid toeneemt. De overgang van actief naar passief gedrag wordt bemoeilijkt. De corrosiesnelheid in de passieve toestand neemt eveneens toe.
5.5 Chloride
Doordat Cl--ionen en in mindere mate ook F-- ,Br-- en I--ionen onder ongunstige omstandigheden kans zien om de passieve oxidelaag te doorbreken, kan het verloop van de anodische tak van de polarisatiecurve er wat anders uit komen te zien. Voordat het transpassieve gebied wordt bereikt bij het geleidelijk verhogen van de potentiaal ontstaan door inwerking van chloride-ionen op de oxidelaag plaatselijk defecten waardoor de stroomdichtheid plotseling toeneemt. De corrosievorm die zich nu voordoet is putvormige corrosie of kortweg putcorrosie. De potentiaal waarbij de stroomdichtheid toeneemt wordt putpotentiaal of pittingpotentiaal genoemd. Op afbeelding 9 is deze potentiaal aangegeven als Eput. De meest opvallende verandering in afbeelding 9 ten opzichte van afbeelding 6 is dat het passieve gebied aanzienlijk is ingekrompen door de aanwezigheid van chloride. De invloed van veranderingen in de pH en de temperatuur is in aanwezigheid van chloride drastischer dan aangegeven op afbeelding 8. Bij een gelijkblijvend chloridegehalte zullen zowel verhoging van de temperatuur als verlaging van de pH-waarde een verkleining van het passieve gebied teweegbrengen. In een verdunde oplossing van zoutzuur is het passieve gebied zelfs geheel uit de polarisatiecurve verdwenen en komt het corrosiegedrag van roestvast staal overeen met dat van koolstofstaal. Een andere manier waarop chloride van invloed is op het corrosieproces is de bevordering van de oplosbaarheid van veel metaalionen door de vorming van complexe ionen. Door de omzetting van opgeloste
metaalionen naar complexe ionen neemt de concentratie afzonderlijke metaalionen in de oplossing af. Hierdoor is het metaal steeds geneigd weer nieuwe metaalionen de oplossing in te sturen, waardoor het corrosieproces blijft verlopen.
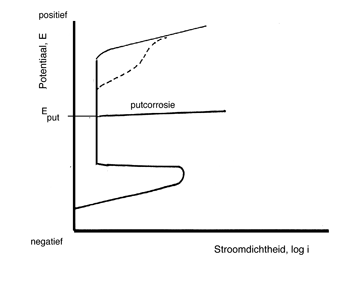
Afbeelding 9 Schematische weergave van het effect dat de aanwezigheid van chloride in het milieu heeft op de polarisatiecurve van roestvast staal.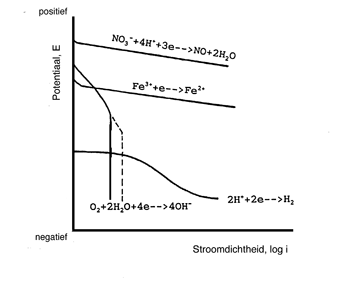
Afbeelding 10 Schematische weergave van de kathodische takken van polariatiecurven opgenomen in verschillende milieus.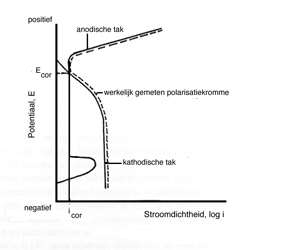
Afbeelding 11 Schematische weergave van de complete polarisatiecurve van roestvaststaaltype AISI 316 opgenomen in zuurstofrijk neutraal water (pH = 7). De streeplijn vertegenwoordigt de polarisatiecurve die daadwerkelijk bij de meting wordt geregistreerd. De corrosiepotentiaal heeft zich ingesteld in het passieve gebied.
5.6 Het oxiderend vermogen
Net zoals voor de anodische tak van de polarisatiecurve de potentiaal vanuit de evenwichtstoestand naar steeds positievere waarden wordt verschoven, kan ook een negatievere potentiaal worden opgedrongen aan een proefstuk. Hierbij neemt de kathodische deelreactie toe en de anodische deelreactie wordt onderdrukt. Dit resulteert in een netto kathodestroom, Ikathode. Door nu steeds een iets negatievere spanning aan te leggen en de zich daarbij instellende stroom te meten en deze waarden in een grafiek uit te zetten, ontstaat de kathodische tak van de polarisatiecurve. Afbeelding 10 toont voor verschillende milieus de kathodische tak. De aanvangspotentiaal en het verloop van de curve bepalen het oxiderend vermogen. Zo kan het oxiderend vermogen van een waterige oplossing vergroot worden door toevoeging van salpeterzuur of Fe3+-ionen. De kathodische tak van de zuurstofreactie blijkt bij een verschuiving naar negatievere potentiaal beneden een bepaalde waarde geen toename in stroomdichtheid meer te veroorzaken. De oorzaak hiervan is dat aanvoer van zuurstof door diffusie hier de traagste stap is en de stroomdoorgang dus beperkt. In water met een hoger zuurstofgehalte, een hogere stroomsnelheid of met turbulentie verplaatst de curve zich naar rechts zoals is aangeven met de streeplijn.
5.7 De praktijk
In voorgaande beschouwing van polarisatie en polarisatiecurven werd de stroom door een uitwendige stroombron geleverd bij een bepaalde elektrodepotentiaal. In de praktijk moeten de anodische en kathodische stroom worden geleverd door de anodische en kathodische deelreacties. Meestal is het zo dat de kathodische deelreactie met de daarbij lopende stroomdichtheid de toestand bepaalt van het roestvast staal in kwestie. Deze toestand is ook af te lezen in de polarisatiecurve, waarbij de zich instellende corrosiepotentiaal met de bijbehorende corrosiestroomdichtheid wordt gevonden uit het snijpunt van de anodische tak van het roestvast staal en de kathodische tak van het milieu dat voor de kathodische reactie(s) zorgt. Dit is schematisch weergegeven op afbeelding 11. Het betreft hier de polarisatiecurve van roestvast staal AISI 316 in een zuurstofrijk neutraal (pH=7) milieu. De kathodische tak is typerend voor de reactie O2 + 2H2O + 4e —> 4OH-, waarbij de maximale kathodische stroomdichtheid wordt beperkt door de aanvoersnelheid van zuurstof naar het metaaloppervlak. De anodische tak vertoont een relatief lage kritische passiveringsstroomdichtheid als gevolg van het molybdenium in AISI 316 en door de neutrale pH en het hoge zuurstofgehalte van het milieu. De polarisatiecurve die daadwerkelijk wordt gemeten in dit voorbeeld is in de grafiek op afbeelding 11 aangegeven met de streeplijn.



