Elektrochemische corrosie: fundamentele begrippen: Deel 4, Corrosiepotentiaal
In het voorgaande is gesproken over de kathodische en anodische deelreacties, die verlopen aan een aan zichzelf overgelaten stuk metaal in een waterig milieu. Na verloop van tijd stelt zich een toestand in waarin de stroomsterkten die met deze deelreacties gepaard gaan gelijk zijn aan elkaar.
Immers in de natuur treedt geen spontane netto-stroomopwekking op. Er geldt dan Ianode = Ikathode. De potentiaal waarbij dit plaatsvindt wordt evenwichtspotentiaal of vrije corrosiepotentiaal of kortweg corrosiepotentiaal genoemd. Deze benamingen worden door elkaar gebruikt. De netto-stroom is dan I = Ianode - Ikathode = 0 De waarde van de corrosiepotentiaal is afhankelijk van zowel het betreffende metaal als van het milieu.
4.1 Corrosiepotentiaal en metaal - galvanische reeks
Koper en zink bezitten in eenzelfde oplossing een verschillende corrosiepotentiaal. De potentiaal van koper is positiever dan die van zink. Dit verschil in potentiaal wordt veroorzaakt door de geringere neiging van koper om in oplossing te gaan, daar waar zink juist een sterkere neiging heeft om in oplossing te gaan. Deze verschillen in potentiaal tussen metalen onderling worden tot uiting gebracht in galvanische reeksen. Metalen en legeringen worden hierin gerangschikt op edelheid. Metalen die in het milieu waarvoor de galvanische reeks geldt edeler zijn staan bovenin de reeks en hebben een positievere potentiaal dan de metalen die lager in de reeks voorkomen. De bekendste galvanische reeks is die van metalen en legeringen in zeewater. Een galvanische reeks geldt slechts in het milieu waarvoor zij is opgesteld. De potentiaalverschillen tussen verschillende metalen kunnen in een ander milieu andere waarden aannemen. Ook kunnen verschillende metalen zelfs van plaats verwisselen in een en dezelfde galvanische reeks in een waterig milieu. Een voorbeeld: zink bij kamertemperatuur is onedel ten opzichte van staal. Boven de 60˚C is zink echter edel ten opzichte van staal in
hetzelfde waterig milieu.
4.2 Meten van een corrosiepotentiaal
Om een galvanische reeks van corrosiepotentialen van verschillende metalen te kunnen opstellen moeten deze gemeten kunnen worden ten opzichte van een constante potentiaal. Deze constante referentiepotentiaal wordt geleverd door een referentieelektrode. Een referentie-elektrode bestaat uit een metaal, ondergedompeld in een milieu met een constante samenstelling. Voor metingen in de bodem wordt hiervoor de robuuste koper kopersulfaatelektrode veel gebruikt. Deze elektrode bestaat uit een stuk koper dat is geplaatst in een verzadigde oplossing van kopersulfaat. De houten prop onderin de elektrode maakt stroomgeleiding mogelijk zonder dat de kopersulfaatoplossing verontreinigd raakt. Een andere veelgebruikte referentie-elektrode is de verzadigde kalomelelektrode. De grote stabiliteit, temperatuurbereik en de gunstige afmetingen van deze elektrode maken haar tot een veelgebruikt instrument. Afbeelding 4 toont een schakeling voor het meten van een corrosiepotentiaal.
4.3 Het milieu en de corrosiepotentiaal
Als een staaf ijzer in een oplossing wordt geplaatst zal zich na verloop van tijd een stabiele toestand instellen waarbij er een evenwicht ontstaat tussen de anodische en de kathodische reacties. Als aanvankelijk de anodische reactie overheerst dan zal er een elektronenoverschot ontstaan in het metaal. Hierdoor wordt het verloop van de anodische reactie geremd en de kathodische reactie bevorderd waardoor er een evenwicht ontstaat. Een schematische weergave hiervan geven afbeelding 5A en 5B. Afbeelding 5A is kenmerkend voor de instelling van de corrosiepotentiaal in een zuurstofarm milieu. Afbeelding 5B is kenmerkend voor het instellen van de corrosiepotentiaal van ijzer gedompeld in een zuurstofrijk milieu. Het verschil in het overschot aan elektronen tussen 5A en 5B nadat zich een evenwichtssituatie met bijbehorende corrosiepotentiaal heeft ingesteld geeft aan dat er een verschil in potentiaal ontstaat tussen een strip staal in een zuurstofrijk en een zuurstofarm milieu.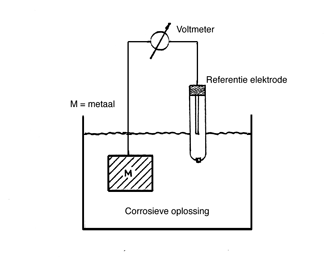
Afbeelding 4 Schakeling voor het meten van een corrosiepotentiaal.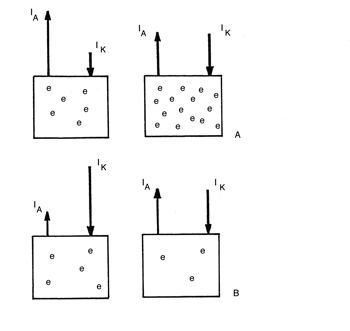
Afbeelding 5 Schematische weergave van het instellen van een corrosiepotentiaal.
Links = situatie direct na onderdompelen
Rechts = evenwicht bij de corrosiepotentiaal
A = aanvankelijke overheersing van anodische reacties (bijvoorbeeld in een zuurstofarm milieu)
B = aanvankelijke overheersing van kathodische reacties (bijvoorbeeld in een zuurstofrijk milieu)
KLIK HIER VOOR DEEL 5



