Elektrochemische corrosie: fundamentele begrippen: Deel 3 Corrosievormen
3.1 Uniforme corrosie
Uniforme corrosie kenmerkt zich door een redelijk gelijkmatige wanddikteafname. Deze corrosievorm wordt doorgaans als minst gevaarlijk beschouwd omdat de corrosiesnelheid uit ervaring bekend is of door experimenten en metingen vrij nauwkeurig is vast te stellen. Hierdoor is de levensduur voorspelbaar en kunnen aan de hand van eenvoudige wanddiktemetingen controles worden uitgevoerd als tussentijdse inspectie. Roestvast staal vertoont aanzienlijke uniforme corrosie in sterke zuren en sterke basen bij hogere temperaturen.
Het principe
Bij uniforme corrosie zijn de anodische en kathodische gebieden zeer klein (ter grootte van een korrel in de microstructuur) en bovendien gelijkmatig verdeeld over het gehele oppervlak. Daarnaast wisselen de anodische en kathodische gebieden van plaats als de corrosie voortschrijdt. Afbeelding 1 en 2 geven aan hoe de reacties aan het metaaloppervlak verlopen in een zuur milieu.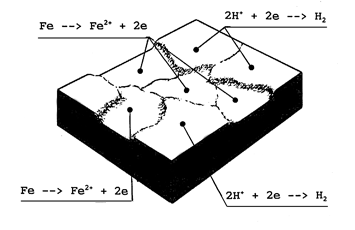
Afbeelding 1 Schematische weergave van het corrosieproces van ijzer in een zuur milieu (merk op dat aan de anodische gebieden metaal in oplossing gaat).
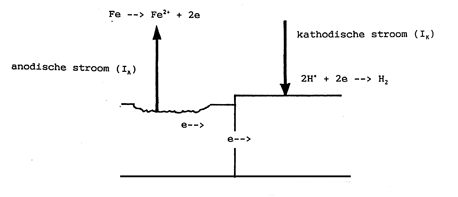
Afbeelding 2 Schematische weergave van het verloop van de deelreacties aan anodische en kathodische gebieden.
De anodische en kathodische gebieden maken automatisch metallisch contact omdat ze aanwezig zijn in hetzelfde stuk corroderend metaal (voorwaarde 4). Aan de overige drie voorwaarden is ook voldaan; er zijn immers anodische en kathodische gebieden en een waterig milieu waar zich de deelreacties afspelen. De kathodische en anodische reacties kunnen niet tegelijkertijd op een en dezelfde plaats op het metaaloppervlak verlopen. Een metaalatoom dat net zijn banden met het omringende atoomrooster heeft verbroken en bezig is om in oplossing te gaan kan niet ook de ontmoetingsplaats zijn voor een vrij elektron en een positief ion uit de oplossing. Een metaaloppervlak moet bestaan uit afzonderlijke anodische en kathodische gebieden waar respectievelijk de oplosreacties en het weer samenkomen van elektronen en positieve ionen uit de oplossing plaatshebben. De kathodische gebieden worden dikwijls gevormd door gebieden waarvan het metaaloppervlak andere chemische kenmerken bezit dan de anodische gebieden. Kathodische reacties verlopen vaak vlotter op insluitsels in het basismetaal of aan bepaalde verbindingen die het basismetaal bevat en waarvan er een aantal aan het metaaloppervlak liggen. In andere gevallen onderscheiden de kathodische gebieden zich wat betreft hun chemische samenstelling niet van de aangrenzende anodische gebieden, maar ontstaan er verschillen als gevolg van mechanische invloeden, zoals plaatselijke deformatie, door verschillen in de kenmerken van een beschermende laag of door verschillen in de samenstelling van het corrosieve milieu.
3.2 Lokale corrosie.
Roestvast staal, maar ook koolstofstaal is onderhevig aan een diversiteit van lokale corrosievormen. Lokale corrosie is een gevreesd verschijnsel. Een minimale verwijdering van metaal door corrosie resulteert in geval van lokale corrosie vaak in scheuren, breuken en lekkage. Hierbij ontstaan risico’s voor mens en milieu terwijl bovendien op financieel vlak schade wordt geleden. Voor roestvast staal is het aantal lokale corrosievormen waarmee rekening moet worden gehouden aanzienlijk. De benaming van de verschillende corrosievormen berust op het visueel waarneembare aantastingsbeeld of verwijst naar de omstandigheden die bijdragen aan het veroorzaken van corrosie. Voorbeelden zijn:
- putcorrosie (het uiterlijk is putvorming);
- spanningscorrosie (een corrosievorm waarbij de aanwezigheid van mechanische spanningen essentieel is);
- spleetcorrosie (aantasting vindt plaats in spleten in de constructie).
Het principe
Het verschil tussen uniforme corrosie en lokale corrosie is dat de anodische en kathodische gebieden ruimtelijk gescheiden zijn en niet steeds van plaats verwisselen als het corrosieproces voortschrijdt. Dit geldt voor alle lokale corrosievormen. Bij diverse lokale corrosievormen is er wel steeds een andere oorzaak die leidt tot het ruimtelijk gescheiden verlopen van de anodische en kathodische reacties. De oorzaken kunnen worden opgesplitst in metaalzijdige inhomogeniteiten en variaties in het milieu. Voorbeelden van metaalzijdige inhomogeniteiten zijn:
- het naast elkaar voorkomen van verschillende fasen in de microstructuur. Bijvoorbeeld uitscheidingen, insluitsels en intermetallische verbindingen kunnen bij voorkeur in oplossing gaan, of austenitisch lasmetaal met daarin een kleine hoeveelheid ferriet;
- opeenhoping van verontreinigingen op korrelgrenzen;
- lokale inwendige mechanische spanningen in het metaal;
- onregelmatigheden aan het metaaloppervlak waaronder krassen en ingedrukte koolstofstaaldeeltjes.
Voorbeelden van milieuzijdige inhomogeniteiten zijn:
- lokale verschillen in zuurstofconcentratie;
- lokale verschillen in de concentratie van opgeloste zouten of metaalionen;
- lokale verschillen in pH-waarde;
- lokale verschillen in temperatuur.
3.3 Invloed van milieuzijdigeconcentratieverschillen
De corrosiviteit van een bepaald waterig milieu voor een bepaald metaal hangt enerzijds af van het gemak waarmee een metaalion zich door een mantel van OH--ionen laat omringen en anderzijds van het gemak waarmee er reacties kunnen verlopen die het elektronenoverschot compenseren. In het voorgaande is wel gezegd dat er ijzer in oplossing gaat in de vorm van ijzerionen, waarbij 2 elektronen in het metaal achterblijven, maar er is nog met geen woord gerept over het waarom van zo’n reactie. Er moet een reden zijn dat een ijzeratoom zijn huidige toestand verwisselt voor een geheel nieuwe. Deze oorzaak moet in geval van een waterig milieu worden gezocht in het feit dat de watermoleculen een bepaalde aantrekkingskracht uitoefenen op de ijzeratomen, in de vorm van het willen omhullen van een uit het metaal getreden ijzeratoom, nu dus een ijzerion, met een watermantel. Dit omhullen met watermoleculen heet hydrateren en hierbij komt energie vrij. Deze vrijkomende energie is de drijvende kracht voor het onttrekken van metaalionen aan het metaalrooster. Sterker in hun rooster gebonden metaalatomen gaan niet zo makkelijk in oplossing terwijl wat minder sterk gebonden metaalatomen dat wel wat makkelijker doen. Dit verklaart waarom een waterig milieu corrosief kan zijn voor bepaalde metalen. De andere factor die van invloed is, is het gemak waarmee een elektronenoverschot wordt weggewerkt. Hiervoor is het nodig dat er op bepaalde plaatsen van het corroderende metaaloppervlak reacties verlopen die gepaard gaan met het opnemen van elektronen. Soms zijn dat in het water opgeloste stoffen zoals H3O+-ionen (gehydrateerde H+- ionen) of Fe3+-ionen die dan overgaan in Fe2+-ionen onder opname van steeds een elektron. Een heel belangrijke reactie in neutrale
waterige milieus is O2 + 2H2O + 4 elektronen → 4OH- (4) Het feit dat een bepaalde deelreactie aan het metaaloppervlak kan verlopen en de intensiteit waarmee dat dan plaatsvindt een krachtige invloed kan hebben op de corrosie kan worden geïllustreerd aan de hand van de volgende proef. Een plaatje koolstofstaal dat eerst metallisch blank is gemaakt en ontvet wordt in een bakje met leidingwater geplaatst. Het geheel staat in open verbinding met de omgevingslucht en wordt aan zijn lot overgelaten. Als dit systeem van dag tot dag wordt gadegeslagen dan blijkt dat het gaat roesten. Dit roestproces verloopt heel geleidelijk. Aan het staaloppervlak verlopen tegelijkertijd de reacties 1 en 4. Vervolgens worden twee even grote plaatjes koolstofstaal
genomen, liefst afkomstig uit een en dezelfde plaat, die metallisch blank worden gemaakt en ontvet. Deze plaatjes worden in een bak geplaatst met leidingwater die in open verbinding staat met de omgevingslucht (zie afbeelding 3). Het bijzondere van deze bak is dat hij is verdeeld in twee even grote compartimenten door middel van een poreuze wand die echter geen zuurstofmoleculen doorlaat. In één compartiment wordt zuurstof doorgeblazen, zodat de zuurstofconcentratie hier aanzienlijk hoger is dan in het aangrenzende compartiment. Er worden twee van zulke opstellingen gemaakt, met dit verschil dat in de ene opstelling de beide plaatjes uitwendig met een stroomgeleidende draad worden verbonden terwijl dat in de andere opstelling niet het geval is. In de niet doorverbonden opstelling blijkt dat het plaatje in het compartiment zonder extra zuurstof op dezelfde wijze roest als het plaatje dat alleen in een bakje stond, zoals hierboven beschreven. Het plaatje in het van extra zuurstof voorziene compartiment roest daarentegen heftiger. Bij de doorverbonden opstelling treedt het tegenovergestelde op: het plaatje in het van extra zuurstof voorziene compartiment roest niet, terwijl het andere plaatje juist heel sterk roest. Wat wil dit nu allemaal zeggen? Uit dit experiment komt naar voren dat extra aanvoer van stoffen die een kathodische deelreactie kunnen geven de corrosie van het metaal versnelt. Verder blijkt hieruit dat variaties in het milieu waarmee het metaal in aanraking komt, in dit geval extra zuurstof in het leidingwater, de corrosie eveneens kunnen versnellen, maar niet alleen dat. Aan de hand van de doorverbonden opstelling is aangetoond dat metaal dat wordt blootgesteld aan een milieu met een sterke scheiding in de concentratie van een of meer bestanddelen die nodig zijn voor de kathodische reactie, sterke lokale corrosie kan ondergaan. Dit verschijnsel heeft verstrekkende technische gevolgen bij constructiedetails waarbij zo’n verschil heel makkelijk kan optreden. Spleetcorrosie en corrosie onder neerslagen zijn hiervan heel bekende voorbeelden. Andere voorbeelden zijn een bochtstuk of ter plaatse van een uitstekende pakkingring waar turbulentie kan optreden in een verder laminaire vloeistofstroom. Door de turbulentie kan plaatselijk een heftiger contact tussen metaal en vloeistof ontstaan waardoor er plaatselijk meer zuurstof naar het metaaloppervlak wordt aangevoerd. Een verschil in zuurstofgehalte kan ook worden veroorzaakt door verschillen in stromingssnelheid. Een in zeewater roterende stalen schijf wordt in het midden sterker aangetast dan aan de randen. Aan de randen is als gevolg van de hogere stromingssnelheid het aanbod van zuurstof hoger. Een laatste voorbeeld is een verschil in zuurstofgehalte aan een grensvlak tussen water en lucht. Belangrijk punt om te onthouden: bij lokale corrosievormen treden de anodische en kathodische reacties ruimtelijk gescheiden van elkaar op.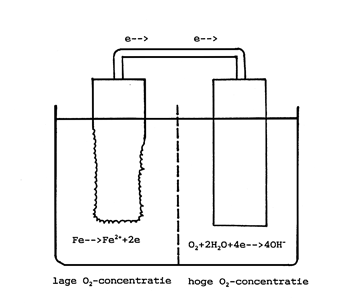
Afbeelding 3 Proefopstelling waarmee lokale corrosie als gevolg van een verschil in zuurstofgehalte in het water wordt aangetoond.



