Elektrochemische corrosie: fundamentele begrippen: Deel 1 en 2 Inleiding
1 Inleiding
Roestvast staal dankt zijn nog steeds toenemende toepassingsbereik, evenals zijn naam aan het gunstige corrosiegedrag dat het materiaal onder vele omstandigheden vertoont. Het kiezen van een geschikt roestvaststaaltype voor een bepaalde toepassing vangt aan met het beoordelen van de corrosieweerstand van een aantal kandidaat-legeringen in het betreffende milieu. Voor een goede beoordeling moet eerst het milieu waarin het roestvast staal dienst moet gaan doen worden gekarakteriseerd, waarbij naast de normale bedrijfsomstandigheden ook eventuele voorspelbare afwijkingen van de normale situatie in acht moeten worden genomen. Zo dient de corrosieweerstand van leidingwerk voor transport van zuivelproducten ook berekend te zijn op spoel- en reinigingsmedia.
De toepasbaarheid van roestvaststaallegeringen kan worden beoordeeld aan de hand van:
- ervaring die in de dagelijkse praktijk is opgedaan met milieumetaalcombinaties;
- laboratoriumonderzoek;
- documentatie die soortgelijke materiaaltoepassingen onder gelijke omstandigheden omschrijft. Als eenmaal de typen met een voldoende corrosieweerstand zijn vastgesteld kan de uiteindelijke keuze worden gemaakt aan de hand van:
- mechanische eigenschappen;
- verwerkbaarheid;
- de mate en de aard van de risico’s die de toepassing met zich meebrengt. Bijvoorbeeld: putcorrosie van een watertank veroorzaakt een relatief onschuldige lekkage, terwijl spanningscorrosie in een reactorvat een levensbedreigende situatie vormt;
- de verkrijgbaarheid van de diverse roestvaststaaltypen in de verschillende productvormen;
- de kosten.
Voorafgaand aan een bespreking van de verschijningsvormen van corrosie van roestvast staal volgt hier een uiteenzetting van een reeks fundamentele begrippen en verschijnselen uit de corrosieleer. Hiermee zijn de processen die bij verschillende corrosievormen van roestvast staal een rol spelen, beter te doorgronden
2 Elektrochemische corrosie
Elektrochemische corrosie is de benaming voor aantasting van metalen, meestal in een waterig milieu en altijd met uitwisseling van elektronen. Elektrochemische corrosie onderscheidt zich op dit punt van andere vormen van aantasting. Chemische aantasting van metalen verloopt zonder elektronenuitwisseling. Voorbeelden van
chemische aantasting zijn:
- reacties van hete gassen met metalen, zoals de oxidatie van roestvast stalen verhittingselementen;
- de aantasting van roestvast staal door contact met hete vloeibare metalen zoals zink of lood.
Bij elektrochemische corrosie verlopen er deelreacties aan het metaaloppervlak die tezamen het oplossen van metaal veroorzaken. De samenwerking van de deelreacties is alleen mogelijk in een milieu waarin ladingtransport kan plaatsvinden. In geval van water is de stroomgeleiding afhankelijk van de in het water opgeloste ionen. Ionen zijn aanwezig in de vorm van H3O+-ionen (gehydrateerde H+-ionen) en OH--ionen afkomstig van afgesplitste watermoleculen. Daarnaast leveren ook in het water opgeloste zouten, zuren en basen de voor stroomgeleiding benodigde ionen. Voorts zijn er plaatsen nodig waar de deelreacties kunnen verlopen. De deelreacties kunnen worden onderscheiden in anodische en kathodische reacties. Anodische reacties worden gedefinieerd als reacties waarbij elektronen worden afgestaan. Het daadwerkelijk oplossen van metalen is een belangrijke anodische reactie. Een voorbeeld hiervan is de oplosreactie van ijzer:
Fe → Fe2+ + 2 elektronen (1)
De plaats aan het metaaloppervlak waar deze reactie verloopt wordt aangeduid als anodisch gebied.
Kathodische reacties worden gedefinieerd als reacties waarbij elektronen worden opgenomen. In een zuur milieu is de overheersende kathodische reactie:
2H+ + 2 elektronen → H2 (waterstofgas) (2)
De plaats aan het metaaloppervlak waar deze reactie verloopt, en waar dus waterstofgas wordt gevormd, wordt aangeduid als kathodisch gebied. De elektronen die bij het oplossen van ijzer (reactie 1) in het metaal achterblijven worden door stroomgeleiding in het metaal getransporteerd naar kathodische plaatsen waar dit overschot aan elektronen wordt opgenomen (reactie 2). Er zij benadrukt dat de reacties 1 en 2 tegelijkertijd verlopen. Dus niet de een na de ander. De totale corrosiereactie kan door combinatie van reactie 1 en 2 als volgt geschreven worden:
Fe + 2H+ → Fe2+ + H2 (3)
Samenvattend zijn voor elektrochemische corrosie de vier essentiële benodigdheden als volgt:
1. anodische gebieden waar de anodische deelreactie verloopt;
2. kathodische gebieden waar de kathodische deelreactie verloopt;
3. een milieu (meestal waterig milieu) met ionen die voor ladingtransport zorgdragen;
4.metallisch contact tussen anodische en kathodische gebieden waardoor stroomgeleiding in het metaal mogelijk is.
Op afbeelding 1 is het corrosieproces van ijzer in een zuur milieu schematisch weergegeven. Dit is het uitgangspunt aan de hand waarvan onderscheid zal worden aangebracht tussen de verschillende corrosievormen die zich voordoen bij roestvast staal.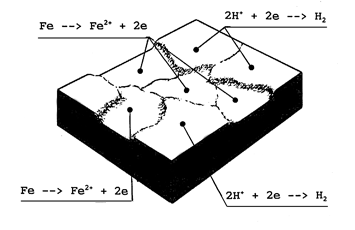
Afbeelding 1 Schematische weergave van het corrosieproces van ijzer in een zuur milieu (merk op dat aan de anodische gebieden metaal in oplossing gaat).



