Het beitsen van roestvast staal
Al naar gelang zijn bewerking ondergaat roestvast staal een aantal specifieke overgangen die afhangen van het uiteindelijke gebruiksdoel. De voornaamste van deze overgangen zijn warm-of koudwalsen om platte produkten te verkrijgen en strekken om langwerpige produkten te maken. Tijdens dergelijke behandelingen reageert het metaaloppervlak met de omgeving en vormt verschillende oxydelagen.
J.P. Michaut
(artikel gepubliceerd in Roestvast Staal nummer 10, 1992- artikel 84)
Het verwijderen van oxydelagen vindt doorgaans plaats in twee stappen:
- door mechanisch verwijderen van aanslag;
- door te beitsen in een elektrolytoplossing, langs thermochemische weg in baden van gesmolten zout, met een zuur.
Beitsen is meestal de laatste behandeling die wordt uitgevoerd om een geschikt metaaloppervlak te verkrijgen, dat wil zeggen vrij van aanslag en geschikt voor koudwalsbewerking of enige andere eindbewerking.
Beitsbehandelingen zijn ook vaak op te delen in twee fasen:
- De voorbereidende fase - In dit stadium wordt wel gezegd dat de oxyden worden geconditioneerd. Deze fase bestaat uit het omzetten van aanslag op een dusdanige wijze dat de naderhand te geven beitsbehandeling veel werkzamer is.
- De eindfase of fase waarin de oxyden vo lledig worden verwijderd - Deze eindfase speelt zich af in een zuur milieu en het doel ervan is het verkrijgen van een metaaloppervlak dat vrij is van oxyden en waarbij terdege is gezorgd dat er geen overbeitsing heeft plaatsgevonden.
Dit overbeitsen heeft aantasting van de korrelgrenzen van het roestvast staal tot gevolg die zelfs kan leiden tot uitbrokkelen van korrels. Het beitsen in zuur wordt toegepast op twee verschillende typen aanslag:
- aanslagprodukten die zijn ontstaan bij warmwalsen (dikke bolvormige aanslag in de orde van grootte van 20 μm);
- aanslagprodukten die zijn ontstaan bij koudwalsen (aanslag is minder dik dan voornoemde, in de orde van grootte van enkele μm).
Elektrolytisch beitsen
Bij dit proces worden de te behandelen werkstukken afwisselend positief en negatief gepolariseerd. De elektrolytbaden zijn neutraal of zuur; het in de oplossing voorkomende anion (=negatief geladen ion) is dikwijls een sulfaat of een nitraat. Als voorbeeld kan een elektrolytisch beitsbad dienen bestaande uit 150 g/l natriumsulfaat. Het polariseren is hier van belang om ter plaatse chemische verbindingen te laten ontstaan in de nabijheid van het metaaloppervlak. Het werkingsmechanisme van deze baden is schematisch als volgt:
-In het anodische gebied verlopen de reacties: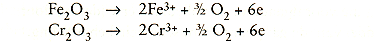
Deze metaalionen reageren vervolgens met watermoleculen: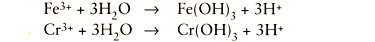
In het kathodische gebied verlopen de reacties: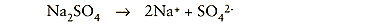
De natriumionen reageren met watermoleculen: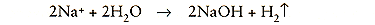
De ontwikkeling van H2-gas doet het oxyde losbrokkelen. Het werkelijk verlopende mechanisme is veel complexer dan hier geschetst. Het is veel beter te begrijpen als er wordt gerefereerd aan polarisatiekrommen. In werkelijkheid treedt er superpositie op van chemische en elektrochemische reacties, maar omdat de elektrolyse plaatsvindt bij constante stroomsterkte is vaak de werkelijke waarde van de potentiaal van het metaal onbekend. Het kan dus voorkomen dat er bij een potentiaal wordt gewerkt waarbij de beitsreactie niet eens kan verlopen en er dus van enige beitswerking geen sprake is. Zo komt bijvoorbeeld chroom voornamelijk in zeewaardige toestand voor, hetgeen noodzakelijkerwijs inhoudt dat:
-hetzij op anodische wijze persulfaatzuur wordt gevormd: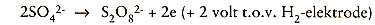
-hetzij een elektrochemische oxydatie plaatsvindt van driewaardig chroom: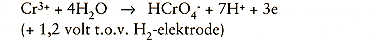
Polarisatiekrommen tonen aan dat het gaat om de Beperkingen van het proces tweede reactie. De zure (HN03) elektrolytische beitsbehandeling versnelt de oplosreacties van de neerslag en van de aangrenzende ontchroomde metaallaag aanzienlijk. Deze behandeling wordt met name toegepast voor koudgewalste produkten.
Thermochemisch beitsen in gesmolten zoutbaden
Oxyderende mengsels
Dit is een chemische omzettingsbehandeling van de aanslag die voorafgaat aan de volledige verwijdering door middel van de gangbare chemische beitsbehandeling. De behandeling in een bad van gesmolten zout bestaat uit het zeer kort (30 seconden tot 4 minuten) onderdompelen van het roestvast staal in een mengsel van gesmolten zouten die een basisch en oxyderend karakter hebben. Een typerend mengsel is het volgende: 85%
NaOH, 14% NaN03, 1% NaCI. Het samensmeltingspunt ligt bij 485°C. De behandelingsinstallatie bestaat uit één of verscheidene bakken met daarin de gesmolten zouten. Het voornaamste doel van deze behandeling is het opwekken van een 'overgeoxydeerde' toestand van de aanwezige oxydelaag. Het chroomoxyde (Cr2O3) bijvoorbeeld wordt dan omgezet in een oplosbare verbinding: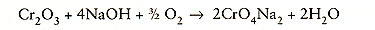
Er verloopt een analoge reactie voor neerslag dat silicium en aluminium in geoxydeerde vorm bevat. Bovendien leidt de thermische schok als gevolg van de plotselinge onderdompeling in het zoutbad tot scheuring van de oxydelaag op het staal zodat het gesmolten zout beter in de laag kan doordringen.
Reducerende mengsels
Het gaat hierbij om mengsels van gesmolten natriumhydroxyde en van natriumhydride. De gemiddelde samenstelling van zo'n mengsel is 98% NaOH en 2% NaH. Door dit mengsel worden op het metaaloppervlak aanwezige oxyden gereduceerd tot metaal volgens: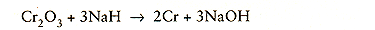
Aangezien er nogal wat risico's zijn verbonden aan het omgaan met hydriden wordt dit mengsel maar zelden toegepast.
Beperkingen van het proces
Behandeling in een bad van gesmolten zouten is zeer doeltreffend. Daar staat echter tegenover dat hun gebruik jammer genoeg wordt beperkt door de volgende factoren:
- de prijs van de toegepaste zouten is betrekkelijk hoog;
- in de baden wordt zeewaardig chroom gevormd dat een groot gezondheids-en milieurisico vormt zodat het spoelwater waarmee de werkstukken worden gespoeld een zeer grondige behandeling moeten ondergaan en er moeten zeer stringente veiligheidsmaatregelen worden getroffen voo r het bedienend personeel.
Beitsen met nitro-waterstoffluoride
Beitsen met nitro-waterstoffluoride is zonder twijfel het proces dat het vaakst wordt toegepast voor de zure beitsing van roestvast staal. Voor vlakke produkten wordt doorgaans een badsamenstelling gehanteerd van 10 tot 25% (gew.) HNO3 (d=1,40) en 1 à 4 % (gew.) HF (d=1,25). De gebruiksteroperatuur ligt in het algemeen in de buurt van de 50°C. De concentraties van de zuren variëren al naar gelang het gaat om koud-of warmgewalste roestvast-staalprodukten.
Mechanisme
Er wordt algemeen aangenomen dat het beitsen van roestvast staal met zuren voornamelijk plaatsvindt door aantasting van de ontchroomde metaallaag aan het oppervlak van de metaalmatrix en niet zozeer door aantasting van de oxydelaag zelf. Er wordt aangenomen dat een beitsbad voor 85% werkzaam is in de vorm van het oplossen van basismetaal en voor de resterende 15% in de vorm van het oplossen van de oxydelaag. Deze zaken hangen af van het soort roestvast staal (ferritisch of austenitisch) en bovenal van de omstandigheden waaronder de laag is ontstaan (temperatuur, partiële zuurstofdruk, tijdsduur enz.).
Er kunnen twee reactievormen worden onderscheiden:
- reacties in de oplossing;
- reacties aan het grensvlak metaal-oplossing.
Reacties in de oplossing
Een beitsbad is een mengsel van verscheidene bestanddelen. In de evenwichtstoestand zijn er verscheidene ion-en molecuulsoorten aanwezig in HNO3-HF baden: 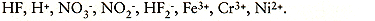
In waterige oplossing en in aanwezigheid van metalen bevat salpeterzuur HN02 en daaruit ontstane dissociatieprodukten die onderling reageren onder vorming van: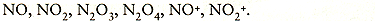
Hetzelfde verhaal gaat op voor HF dat reageert met Fe3+ (en Cr3+) waarbij drie complexe iontypen ontstaan volgens: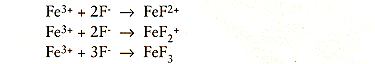
Met behulp van de beginconcentraties HNO3 en HF kan de verhouding tussen de bestanddelen van de oplossing worden geregeld en daarmee de beitsende werking. Zo zorgt toevoeging van HF aan een middelmatig geconcentreerd bad voor terugwinning van salpeterzuur volgens: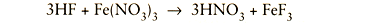
Reacties aan grensvlak metaal-oplossing
Studies over de evenwichten geoxydeerd metaal-oplossing hebben de rol van de bestanddelen van nitro-waterstoffluoridebaden aan het licht gebracht. Daarbij wordt aangenomen dat de volgende reacties verlopen:
a) Aantasting van de ontchroomde laag:
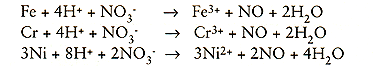
b) Aantasting van de oxyden door een reactie van hetzelfde type onder vorming van kationen (positieve ionen) en ontwikkeling van NO-gas. Deze laatste wordt in de lucht geoxydeerd tot NO2 (nitreuze damp).
Experimentele studies met betrekking tot het HNO3-HFproces hebben uitgewezen dat:
• HF fungeert als:
- donor van H+-ionen
- complexvormen van Fe3+-ionen en Cr3+-ionen
- stabilisator van de redoxpotentiaal van de baden
- werkzame depassivator van de passieve laag die wordt gevormd door een mengsel van ijzeroxyden en ijzernitriden.
Deze rol is met name van belang omdat de aanwezigheid van ijzer de vorming van een visceuze laag van het type NO2αFeγ met zich meebrengt. Toename van het gehalte aan HF leidt tot complexvorming van de Fe3+-ionen en daarmee vernietiging van deze visceuze, passieve laag.
• HNO3 fungeert als:
- donor van H+-ionen
- middel ter verhoging van de reductiepotentiaal van oxyden
- passivator
- oxydatiemiddel van het metaal
- oplosmiddel van neerslag
Het nitro-waterstoffluorideproces geeft vrij goede oppervlaktekarakteristieken, maar het geeft toch het nodige ongerief dat voornamelijk samenhangt met de aanwezigheid van salpeterzuur. Dit ongerief bestaat uit de aanwezigheid van nitraten in het afvalwater. Dit is dan ook een van de redenen dat er naarstig wordt gezocht naar nietvervuilende beitsbaden.
Controle en veiligheid
Controle van beitsbaden
De analysemethoden voor beitsbaden doen een beroep op een zeer bijzonder concept: in feite bestaat een beitsbad uit een mengsel van zuren en metalen dat in een thermodynamisch evenwicht verkeert. De controle van deze baden bestaat uit een toestandsanalyse ofwel een analyse van de bestanddelen in oplossing (met inbegrip van ' vrij' HF). Er wordt gebruik gemaakt van potenriometrische tirrage voor de bepaling van H+-ionen en van atomaire absorptiespectramerrie of van emissiespectrometrie voor het bepalen van de mengverhouding van de metalen. De voornaamste moeilijkheid van de titrimetrische methoden is gelegen in het feit dat er een verdunning nodig is van de genomen badmonsters hetgeen kan leiden tot een verschuiving van het evenwicht en daarmee een wijziging in de hoeveelheden van de aanwezige stoffen . Directe potenriomerrie is echter een geschikte methode voor deze controle. Hiervoor zijn apparaten in de handel, voorzien van twee elektroden: de een voor H+-ionen en de ander voor F--ionen.
Controle van de oppervlaktetoestand van het staal
In de regel wordt de korrelgrootte gemeten en wordt verder het metaaloppervlak visueel beoordeeld. De oppervlaktetoestand van hetgebeitste roestvast staal wordt regelmatig met behulp van fluoriscentiespectrometrie beoordeeld.
Veiligheid bij het werk
Er moeten zeer strenge regels worden gehanteerd bij de behandeling van zuren en er moeten in roestvast-staalbeitserijen stringente veiligheidsmaatregelen worden genomen. Deze maatregelen moeten vooral zijn toegespitst op gesmolten natriumhydroxyde en waterstoffluoridezuur. Deze laatste is bijzonder gevaarlijk omdat hij organische weefsels doet afsterven en als het in de ogen terechtkomt (bijvoorbeeld door spatten) dan heeft dit zeer ernstige gevolgen. Veiligheidsmaatregelen voorzien dan ook in de eerste plaats beschermende kleding en veiligheidsbrillen die de ogen volledig afschermen.



