Putcorrosie van aluminium
In dit artikel zal worden ingegaan op het corrosiegedrag van aluminium in waterige milieus. Speciale aandacht zal in dit verband het verschijnsel putcorrosie krijgen. De gebruikte onderzoeksresultaten zijn deels van eigen hand en deels overgenomen uit bestaande literatuur over dit onderwerp.
J. H. Vonk
Theorie
2.1 Corrosie van aluminium
In een waterig milieu hebben aluminium en zijn legeringen heel wat te verduren. Als de omstandigheden 'gunstig' zijn kan aluminium aan zeer vele vormen van corrosie ten prooi vallen. De belangrijkste vormen van corrosie die aluminium in waterig milieu te duchten heeft zijn (zie afbeelding 1 ):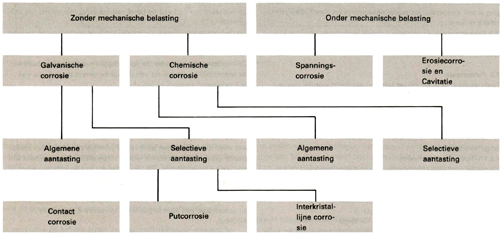
Afbeelding 1: Overzicht van corrosievormen bij aluminium in waterig milieu.
1. Zonder mechanische belasting:
1.1 Galvanische corrosie wordt veroorzaakt door een elektrochemisch potentiaalverschil tussen twee aangrenzende vlakken.
1.1.1 Deze vorm van corrosie kan op macroscopische schaal optreden, er wordt dan gesproken van contactcorrosie. Deze vorm van corrosie treedt bijvoorbeeld op bij het contactvlak tussen een koperen bout en een aluminium plaat.
1.1 .2 Op microscopische schaal veroorzaakt een verschil in elektrochemische potentiaal putcorrosie : putvormige aantasting van het oppervlak, of interkristallijne corrosie: aantasting op de korrelgrenzen van het aluminium.
1.2 Bij chemische corrosie lost het aluminium met een zekere snelheid op in het milieu (ook aan deze vorm van corrosie zit veelal een elektrochemisch aspect).
1.2.1 Dit kan gelijkmatig over het hele oppervlak gebeuren. Beruchte milieus in dit opzicht zijn logen (NaOH, KOH, etc.), zoutzuur (HCI) en fluorwaterstof (HF) in hogere concentraties.
1.2.2 Selectieve chemische aantasting komt ook voor, bijvoorbeeld het preferent oplossen van bepaalde precipitaten in een specifiek milieu. Hiervan wordt dankbaar gebruik gemaakt bij het bereiden van etsmiddelen in de metallografie.
2. Onder mechanische belasting :
2.1 Corrosie van elektrochemische aard onder mechanische belasting wordt aangeduid als spanningscorrosie en treedt alleen in specifieke milieus op.
2.2 Erosiecorrosie en cavitatie worden veroorzaakt door de schurende werking en turbulentie van een stromend milieu resp. implosies t.g .v. drukvariaties.
2.2 Putcorrosie
Zoals gezegd zal in dit artikel speciaal aandacht worden besteed aan putcorrosie van aluminium in waterig milieu.
2.2.1 Putinitiatie
Over het ontstaan van putten in het oppervlak van aluminium als gevolg van het milieu, waarin dit oppervlak zich bevindt, zijn verscheidene theorieën opgesteld. Volgens Böhni (1) zijn de drie belangrijkste modellen:
2.2.1 .1 Het adsorptie model.
Dit model gaat uit van adsorptie van halogeenionen aan de beschermende oxidehuid. Als gevolg van een reactie tussen de oxidehuid en de plaatselijk geconcentreerde halogeen (bijvoorbeeld Cl - -ionen) lost deze beschermende oxidehuid op volgens :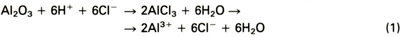
Het aluminium dat zo bloot komt te liggen lost eenvoudig op en er ontstaat een putje in het oppervlak.
2.2.1 .2 Het ionpenetratiemodel.
In tegenstelling tot het eerste model lossen de halogenen de oxidehuid niet op. Echter men gaat ervan uit dat wanneer het elektrochemisch potentiaalverschil tussen het metaal en het milieu een bepaalde kritische waarde overschrijdt de halogeenionen de oxidehuid beginnen binnen te dringen. Zo ontstaat een vervuilde oxidehuid die gemakkelijker wordt aangetast door het milieu. Hierdoor komt het onderliggende metaal bloot te liggen en dit lost op.
2.2.1.3 Het 'Mechanica! Film Breakdown' model.
Dit model gaat uit van een mechanische beschadiging van de oxidehuid. Deze beschadiging kan het gevolg zijn van plaatselijk hoge spanningen in de oxidehuid, inwendige spanningen in het materiaal of een uitwendige beschadiging van de oxidehuid. Door deze beschadigingen kan het milieu binnendringen en het aluminium oplossen.
2.2. Het uitgroeien van een put
Een eenmaal geïnitieerde put vormt een zichzelf in stand houdend systeem en blijft, mits het milieu een oxiderende component bevat (O2, Fe3+, e.d.), in principe ongelimiteerd doorgroeien. Dit kan geïllustreerd worden aan de hand van het volgende model (zie ook afbeelding 2).
Op de bodem van de put, de anode, vindt de volgende oplosreactie plaats :
De noodzakelijke tegenreactie (kathodische reactie) vindt plaats in de onmiddellijke omgeving van de put en omvat de reductie van een oxiderend element of ion, dus
De aanwezigheid van positief geladen aluminiumionen in de put trekt negatief geladen halogeenionen (bijvoorbeeld Cl - ) aan. Hierdoor daalt de pH in de put (reactie 4)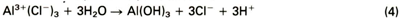
wat weer extra Cl - -ionen aantrekt. In principe zal de put dus steeds sneller groeien. Er zijn echter wel factoren die de groeisnelheid van een put kunnen remmen. Dit zijn onder andere de snelheid waarmee de Cl - -ionen aangevoerd kunnen worden en de verstoppende werking van de corrosieprodukten die ontstaan als gevolg van reactie 4 (de karakteristieke witte neerslag die wordt waargenomen bij putcorrosie aan aluminium is het in reactie 4 gevormde AI(OH3).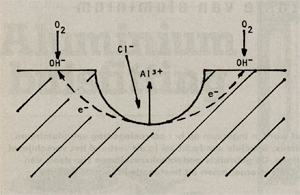
Afbeelding 2: Schematische voorstelling van putcorrosie aan aluminium.
2.3 Factoren die de putcorrosiebestendigheid van aluminium beïnvloeden
Zoals te verwachten zijn aluminium en zijn legeringen niet in alle omstandigheden even gevoelig voor putcorrosie. Verschillende factoren, zoals samenstelling, milieu en microstructuur, bepalen in welke mate aluminium gevoelig is voor putcorrosie. Enkele van deze factoren, met name de invloed van het chloridegehalte en de pH van het milieu, de invloed van de legeringselementen chroom en mangaan en de invloed van de oppervlaktegesteldheid zijn voor dit artikel onderzocht. De resultaten met betrekking tot de invloed van chloridegehalte, pH en oppervlaktegesteldheid zijn uit eigen onderzoeking voortgekomen. De feiten met betrekking tot legeringselementen zijn overgenomen uit een artikel van Holtan en Sigurdsson (2).
2.4 Onderzoeksmethode
Het onderzoek naar de invloed van het milieu, de oppervlaktegesteldheid en de legeringselementen op de pittingpotentiaal en de repassiveringspotentiaal is gedaan door met behulp van een potentiastaat de polarisatiekrommen van aluminium proefstrips op te nemen. Het onderzochte aluminium is AA 5052, aluminium met 2,5 gew% magnesium en 0,25 gew% chroom. De meetopstelling waarmee dit gebeurt, is schematisch weergegeven in afbeelding 3.
De werkwijze bij het opnemen van een polarisatiekromme met behulp van een potenticstaat is als volgt: Drie elektroden, de werk (het te onderzoeken monster), de referentie- (hier een calomel elektrode) en de tegenelektrode (een platina-elektrode), worden gedompeld in een geleidend milieu. Met behulp van de potenticstaat wordt het potentiaalverschil tussen de werkelektrode WE en de referentieëlektrode RE in een constant tempo opgevoerd. Om dit potentiaalverschil op te voeren vergelijkt de potenticstaat het ingestelde potentiaalverschil met het potentiaalverschil tussen WE en RE en past dit laatste potentiaalverschil aan met behulp van een elektrische stroom tussen WE en de tegenelektrode AE, zodanig dat het potentiaalverschil tussen WE en RE gelijk wordt aan de ingestelde potentiaal.
Door nu de stroom die tussen WE en ER loopt tegen de ingestelde potentiaal grafisch uit te zetten wordt een kromme, polarisatiekromme genaamd, verkregen. Een schematische voorstelling hiervan is weergegeven in afbeelding 4. Als we de polarisatiekromme van onder naar boven volgen dan gebeurt achtereenvolgens het volgende. Bij sterk negatief potentiaalverschil tussen WE en RE loopt er een kathodische stroom, dat wil zeggen de stroom loopt van WE door de testoplossing naar AE. In dit gebied bezit het aluminium geen beschermende oxidefilm, het proefplaatje is hier echter kathodisch beschermd en wordt dus niet aangetast.
Bij een bepaalde potentiaal loopt er geen stroom meer tussen WE en RE, hier wordt op het aluminium een passieve oxidefilm gevormd, het metaal passiveert. De potentiaal waarbij dit gebeurt wordt de passiveringspotentiaal EPAS genoemd. In theorie zou er alvorens het aluminium passiveert eerst nog een anodische stroom, dus een stroom van AE naar WE, moeten lopen (in afbeelding 4 met een stippellijn aangegeven). Doordat deze stroom zeer klein is, wordt deze in de praktijk bij aluminium vrijwel nooit waargenomen, tenzij de stroom logaritmisch tegen de potentiaal wordt uitgezet.
Over een vrij groot potentiaalgebied gedraagt het aluminium zich passief. Bij een bepaalde potentiaal slaat de beschermende oxidefilm door, dit gebeurt over het algemeen plaatselijk. Na het doorslaan van de oxidefilm corrodeert het aluminium op de plaats van doorslag, dit is te zien aan de anodische stroom die bij het overschrijden van deze potentiaal gaat lopen. De potentiaal waarbij dit gebeurt wordt de pittingpotentiaal EPIT genoemd, omdat er putjes in het oppervlak ontstaan als gevolg van corrosie op de plaatsen waar de oxidehuid is doorgeslagen. Wordt het potentiaalverschil tussen WE en RE na het doorslaan weer sterker verkleind, dan zal bij een bepaalde potentiaal, negatiever dan EPIT, het aluminium zich weer passief gaan gedragen. De potentiaal waarbij dit gebeurt, wordt de repassiveringspotentiaal EREP genoemd.
Aan de hand van een polarisatiek.romme kan een indicatie worden verkregen van de agressiviteit van het milieu voor het materiaal waaruit het proefstaafje vervaardigd is, door de ligging van de redoxpotentiaal van het milieu ERED ten opzichte van EPIT en EREP te interpreteren. Ligt ERED boven zowel EPIT als EREP dan zal putcorrosie optreden, daar de potentiaal die het aluminium opgedrongen krijgt boven de pittingpotentiaal van het aluminium ligt. Ligt ERED tussen EPIT en EREP in dan zal in principe geen putcorrosie plaatsvinden, treedt echter om enige reden toch putcorrosie op (bijvoorbeeld door een tijdelijke stijging van ERED) dan zullen de ontstane putjes niet meer repassiveren. Pas als ERED negatiever is dan zowel EPIT als EREP is het aluminium gevrijwaard voor putcorrosie.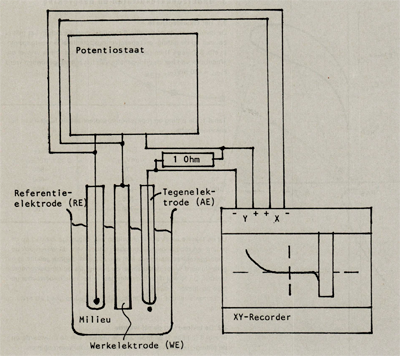
Afbeelding 3: Schematische meetopstelling voor het opnemen van polarisatie krommen.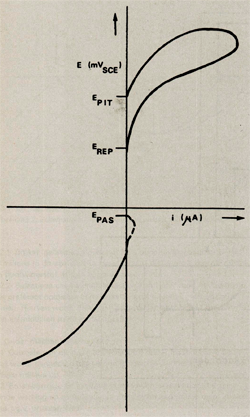
Afbeelding 4: Schematische voorstelling van een polarisatie kromme van aluminium.
3. Onderzoeksresultaten en bespreking
3.1 Het chloridegehalte
De invloed van de hoeveelheid chlorideïonen die zich in het milieu bevindt op de pitting- en repassiveringspotentiaal is weergegeven in afb. 5 (bijlage 1) en tabel 1. De redoxpotentiaal bleek vrijwel onafhankelijk van het chloridegehalte van het milieu, gevonden werd ERED = 400 mVSCE.
Uit de theorie bleek al dat chloriden een ongustige invloed op de pitting-en repassiveringspotentiaal uitoefenen; dit wijzen ook de onderzoekersresultaten uit. Met een stijgend chloridegehalte in het gedestilleerd water dalen zowel de pitting- als de repassiveringspotentiaal. Dit terwijl de redoxpotentiaal in het hele onderzochte gebied positiever is dan EPIT.
Putcorrosie zal dus in het onderzochte gebied zo goed als zeker optreden.
3.2 De invloed van de pH-waarde
In afb. 6 (bijlage 1) en tabel 2 is de invloed van de pH-waarde op de pitting-, repassiverings- en redoxpotentiaal weergegeven.
Uit de resultaten blijkt dat het aluminium in het neutrale en licht basische gebied (pH tussen 7 en 10,5) het best bestand is tegen corrosie in een waterig, chloridevrij milieu, met dien verstande dat ontstane putjes gezien de ligging van de repassiveringspotentiaal niet meer zullen repassiveren. In het zure en basische gedeelte van de grafiek is de corrosiebestandheid beduidend lager. Bij meting in het pH-gebied hoger dan 11 bleek zelfs dat het aluminium zo hevig werd aangetast dat het nauwkeurig opnemen van een polarisatiekromme onmogelijk werd. In deze uiteinden van de pH-schaal vindt dan ook chemische aantasting plaats, die zich aan de elektrochemische meetmethoden onttrekt.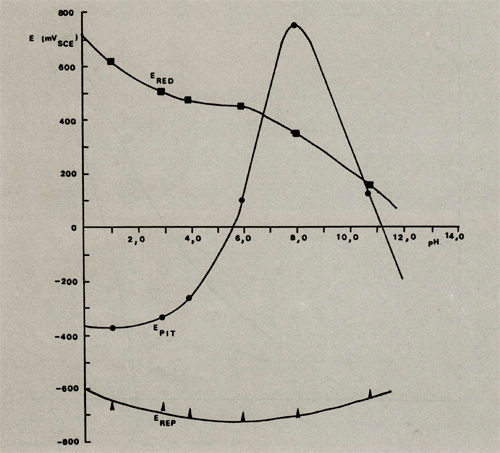
Afbeelding 5: De redox-, pitting- en repassiveringspotentiaal als functie van de pH van gedestilleerd, chloridevrij water bij kamertemperatuur.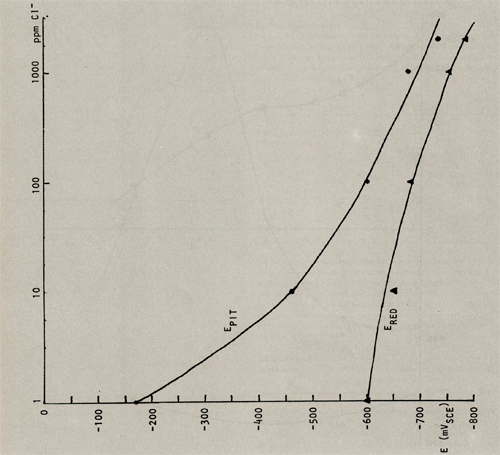
Afbeelding 6: De pitting- en repassiveringspotentiaal als functie van het chloridegehalte van gedestilleerd water (pH = 6,5; ERED= 400 mVSCE) bij kamertemperatuur.
3.3 De invloed van de legeringselementen chroom en mangaan
Door Holtan en Sigurdsson (2) zijn de invloeden van de legeringselementen chroom en mangaan in AIMg2,7 legeringen op de pittingpotentiaal onderzocht. De resultaten van dit onderzoek zijn grafisch weergegeven in de afbeeldingen 7, 8, 9 en 10 (bijlage 1).
Hierbij valt op dat chroom een gunstige invloed op de pitting potentiaal heeft, mits het als enig legeringselement wordt toegepast. Echter wanneer de legering ook mangaan bevat, beïnvloedt chroom de pittingpotentiaal in ongustige zin. Mangaan beïnvloedt de pittingpotentiaal gunstig wanneer het gehalte onder de 0,5 gew% blijft, daarna wordt de gunstige invloed weer tenietgedaan. Wordt naast mangaan ook chroom bijgelegeerd dan verschuift de waarde tot welke mangaan de pittingpotentiaal gunstig beïnvloedt naar lagere gewichtspercentages (in A1Mg2,7Cr0,14 is deze waarde 0,25 gew% Mn).
3.4 De oppervlaktegesteldheid
In tabel 3 zijn de resultaten met betrekking tot de putcorrosiebestandheid en de oppervlaktegesteldheid van het aluminium weergegeven. De redoxpotentiaal van het milieu (leidingwater) bleek 63 mVSCE te zijn.
Uit de gevonden waarden voor EPIT en EREP blijkt dat aluminium, met uitzondering van geanodiseerd aluminium, niet bestand is tegen leidingwater. Wordt de pitting potentiaal, los van het milieu, in relatie tot de oppervlaktegesteldheid beschouwd dan blijkt elke mechanische beschadiging van het oppervlak een nadelige invloed op de pittingpotentiaal te hebben. Een verklaring hiervoor is dat volgens de 'Mechanica! Film Breakdown'-theorie putcorrosie makkelijker op een beschadigde dan op een intacte oxidefilm initieert. Beschadiging van het oppervlak doet de beschermende werking van een geanodiseerde laag volkomen te niet, de putcorrosiebestandheid van een geanodiseerd en beschadigd oppervlak is gelijk aan die van een onbehandeld en beschadigd oppervlak. Verder is te zien dat böhmiteren geen noemenswaardige invloed op de putcorrosiebestandheid heeft.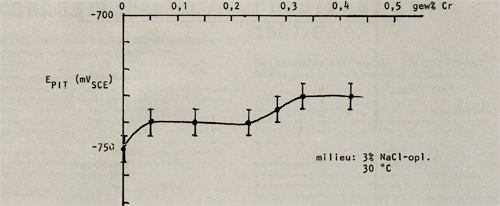
Afbeelding 7: De pitringpotentiaal als functie van het chroomgehalte in AIMg2,7Cr.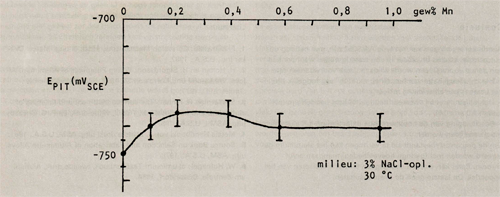
Afbeelding 8: De pitringpotentiaal als functie van het mangaangehalte in AIMg2,7Mn.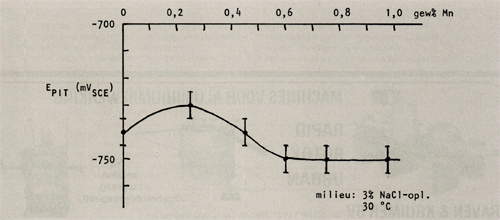
Afbeelding 9: De pitringpotentiaal als functie van het mangaangehalte in AIMg2,7CrO, 14Mn.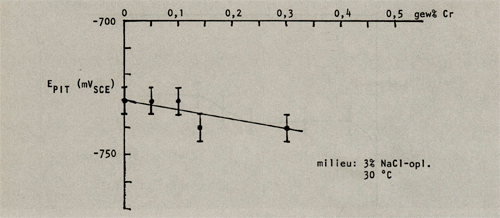
Afbeelding 10: De pitringpotentiaal als functie van het chroomgehalte in AIMg2,7MnO,43Cr.
Conlusie
Aluminiumlegeringen van het type AA 5052 zijn, met het oog op putcorrosie, slechts bruikbaar in een waterig milieu wanneer aan een aantal voorwaarden wordt voldaan. Deze voorwaarden zijn :
- Het chloridegehalte van het milieu moet zo laag mogelijk zijn, het beste is een chloridevrij milieu.
- Het milieu moet bij voorkeur neutraal of licht basisch zijn (pH tussen 7,0 en 10,5).
- Beschadiging van de beschermende oxidefilm op het aluminium moet vermeden worden.
Om de putcorrosiebestandheid te verhogen kan het aluminium gelegeerd worden met (geringe hoeveelheden) mangaan en/of chroom. Beter kan worden overgegaan tot het anodiseren van het oppervlak. Dit laatste geeft de beste resultaten.
Literatuur
1. F. Mansfeld: Gorrosion Mechanisms, hfdst. 6. uitg. Marcel Dekker lnc., U.S.A., 1987.
2. H. Holtan en H. Sigurdsson : Pitting Potentials of Aluminium Alloys, Werkstofte und Korrosion 28, 1977, uitg. Verlag Chemie GmbH, BRD, 1977.
3. S. Wernick, R. Pinner: The surface treatment and finishing of aluminium and its alloys, vol. 1 en 2, vijfde druk, en P. G. Sheasby, uitg. ASM I, U.S.Ä. , 1987.
4. Metals Handbook, vol. 1, achtste druk, uitg. ASM, U.S.A., 1961.
5. Souree Book on Selection and Fabrication of Aluminium Alloys, uitg. ASM, U.S.A., 1978.
6. W. Hufnagel: aluminium-Taschenbuch, tweede druk, Aluminium- Zentrale, Düsseldorf, 1984.



