Blog Ko Buijs - Het winnen van titaan uit zijn erts
Titaan wordt vanuit erts gewonnen, dat rutiel of soms ook ilmeniet wordt genoemd. Rutiel is feitelijk geoxideerd titaan wat een sterke binding betreft tussen titaan en zuurstof, terwijl ilmeniet een verbinding is van titaan, zuurstof en ijzer. Wij beperken ons in dit blog tot het meest voorkomende erts en dat is titaandioxide, dat dus rutiel wordt genoemd.
Door Ko Buijs - Innomet Consultancy BV
Het vraagt bijzonder veel energie om titaan uit dit erts vrij te maken. Bij het chemisch vrij maken van ijzer uit ijzererts, is slechts één reductieproces nodig wat in een hoogoven plaatsvindt; in het geval van titaan zijn er minstens twee nodig. Ook is het gebruik van een ander reactief metaal noodzakelijk om deze reductie mogelijk te maken. Hiervoor worden de reactieve metalen magnesium of natrium gebruikt. Deze elementen hebben ook een reductieproces ondergaan, om op hun beurt weer uit hun verbindingen vrijgemaakt te worden. Met andere woorden, getotaliseerd is er veel energie nodig en dat komt de kiloprijs van titaan niet ten goede. Overigens denkt men nog wel eens dat titaan als het ware onbetaalbaar zou zijn, maar dat is een groot misverstand. Het mag dan wel duurder zijn dan roestvast staal maar het interessante soortelijke gewicht compenseert voor een groot deel deze meerprijs. Ook heeft men geen corrosietoeslag nodig en dat leidt mede tot een acceptabele aanschafprijs. Het vrijmakingsproces vanuit erts verloopt als volgt: rutielerts wordt met cokes gechloreerd waardoor titaantetrachloride en koolzuur ontstaat. Titaantetrachloride is een kleurloze vloeistof dat gezuiverd wordt voordat het verder verwerkt mag worden. Titaantetrachloride plus magnesium wordt in een inerte omgeving chemisch omgezet in sponsachtig titaan en magnesiumchloride. Dit proces kan op dezelfde wijze ook plaatsvinden met natrium, waardoor er natriumchloride als bijproduct ontstaat. Titaanspons wordt geperst tot blokken en inert gesmolten tot gietelingen; desgewenst kan deze smelt aangevuld worden met legeringselementen en titaanschroot. De gietelingen worden op hoge temperatuur gewalst of gesmeed tot halffabricaat Afbeelding 1: schematische weergave hoe het metaal titaan ontstaat.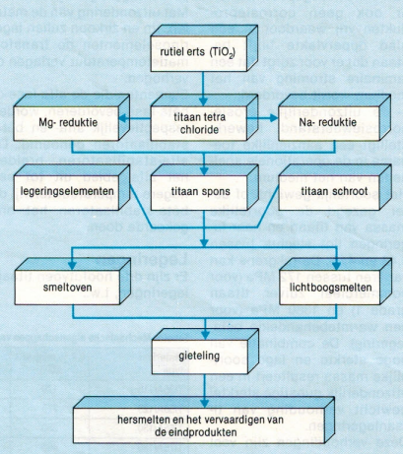
Op afbeelding 1 zijn schematisch de verschillende reductieprocessen weergegeven om titaanerts om te zetten naar het metallische titaan.
Zoals eerder is gesteld, vragen de genoemde reductieprocessen veel energie en dat bepaalt voor een groot deel de aanschafprijs van titaan. Nadat titaanspons tot blokken is geperst, worden deze in een smeltoven omgezet in gietelingen, die op hun beurt verder worden verwerkt tot halffabricaten. Titaanspons wordt meestal gesmolten in vacuüm met een elektrische boog. Het geperste spons wordt hier feitelijk de elektrode. De hoge temperatuur, die door de boogontlading wordt verkregen, wordt gebruikt om deze elektrode in een vacuümomgeving te smelten. De gesmolten titaandruppels stollen daarna in een watergekoelde koperen smeltkroes om zo een titanium billet te vormen. Voor bepaalde hoogwaardige toepassingen kunnen meerdere smeltrondes nodig zijn teneinde de vereiste zuiverheid te verkrijgen. Indien er gelegeerd titaan moet worden gemaakt, kunnen tijdens dit smelten de gewenste elementen worden toegevoegd. Landen waar titaanerts in rijke mate wordt gevonden zijn Canada, India, China, Noorwegen, Zuid-Afrika, Oekraïne, Sierra Leone en Mozambique. Titaan is op drie elementen na, het meest voorkomende element op 
Afbeelding 2: het periodieke systeem.
Titaan behoort tot de zogenaamde overgangsmetalen en bevindt zich in het periodieke systeem van de elementen in groep vier (afbeelding 2). Het periodieke systeem geeft een gestructureerd overzicht van alle bekende chemische elementen en biedt belangrijke informatie over hun structuur, eigenschappen en chemisch gedrag. Het atoomgetal van titaan is tweeëntwintig en dat betekent dat het atoom tweeëntwintig protonen en elektronen bezit. Ook blijkt dat titaan in het periodieke systeem zich genesteld heeft tussen de zustermetalen vanadium, zirkoon, hafnium en tantaal.




