Toepassing van selectieve chemische kleuring voor de recycling van roestvast staal
Bij het shredden en verwerken van auto- en welvaartsschroot wordt onder andere een stroom zware non-ferrometalen geproduceerd met voornamelijk zink, lood, koper, koperlegeringen en roestvast staal. Het deel van dit materiaal dat groter is dan 64 mm wordt vaak naar lagelonenlanden gestuurd om te laten handsorteren. Deeltjes groter dan 4 en kleiner dan 64 mm worden door een combinatie van technieken gescheiden; het deel dat kleiner dan 4 mm wordt momenteel gestort. Om roestvast staal te scheiden van de andere metalen kunnen mechanische of automatische optische scheidingstechnieken toegepast worden. De scheiding van roestvast staal door mechanische scheidingsmethoden is echter problematisch, waardoor nascheiding met behulp van handsorteren altijd noodzakelijk is.
Door: Jochem Rendorp, Norbert Fraunholcz, Wijnand Dalmijn Technische Universiteit Delft, Faculteit der Technische Aardwetenschappen, Sectie Grondstoffenverwerking.
De reden hiervoor is dat secundair roestvast staal geen karakteristieke eigenschap bezit op basis waarvan mechanische scheidingsmethoden toegepast kunnen worden. Maar ook automatische optische scheiding wordt bemoeilijkt, doordat bijvoorbeeld de kleur van secundaire roestvaststaaldeeltjes uiteenloopt van licht- tot donkergrijs en het bovendien bruin verroest kan zijn. In secundaire non-ferrostromen is roestvast staal daarom soms zelfs met het oog moeilijk van andere metalen te onderscheiden. In het kader van een afstudeeronderzoek [1] aan de TU Delft is een snelle chemische methode ontwikkeld om roestvast staal selectief te kleuren, waarna het eenduidiger gedetecteerd en geconcentreerd kan worden door bestaande geautomatiseerde optische scheidingstechnieken.
Artikel uit RVS1 2000
Geautomatiseerde optische scheiding
Optische scheidingstechnieken maken gebruik van een lichtgevoelige sensor die een bepaalde optische eigenschap van de te sorteren deeltjes meet [2]. Deze sensor is aangesloten op een computer die met behulp van het signaal van de sensor de deeltjes classificeert. Vervolgens geeft de computer een signaal door aan een mechanisch apparaat, dat geselecteerde deeltjes uit de deeltjesstroom verwijdert. Op afbeelding 1 is dit principe schematisch weergegeven. Bij dit TU Delft-onderzoek is gebruikgemaakt van een digitale (CCD) zwartwit videocamera als sensor, waarmee deeltjes bekeken zijn met een resolutie van 500 pixels/cm2. Elk pixel heeft een bepaalde grijswaarde tussen de 0 (zwart) en 255 (wit). Het beeld is vervolgens softwarematig bewerkt met de zogenaamde ‘threshold’-functie. Hiermee worden alle beeldpunten boven een ingestelde grijswaarde wit gemaakt, de andere zwart. Zo kunnen, bij gebruik van een zwarte achtergrond, donkere deeltjes uit het beeld gefilterd worden. Afbeelding 2 illustreert dit. Ook laat deze figuur twee problemen zien die bij directe optische detectie van roestvast staal optreden. Ten eerste is een van de vijf stukken roestvast staal vrij donker, waardoor het niet gedetecteerd wordt. Dergelijke deeltjes belanden dus niet in het concentraat, wat de scheidingsresultaten negatief beïnvloedt. Ten tweede wordt een koperdraad met licht gekleurde isolatie gedetecteerd doordat hij op basis van grijswaarde moeilijk van roestvast staal te onderscheiden is. Dergelijke roestvaststaaldeeltjes kunnen daarom in het roestvaststaalconcentraat belanden, wat het roestvaststaalgehalte van het concentraat verlaagt.
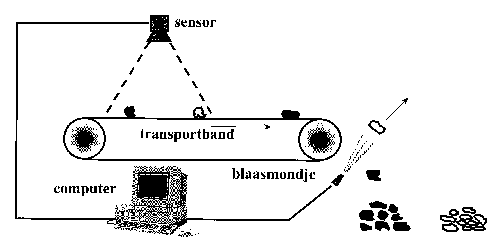
Afbeelding 1 Schematische opstelling van een geautomatiseerde optische scheidingsinstallatie.
Achtergrond van selectieve chemische kleuring
Tot in de jaren zestig werden chemische stoffen ge bruikt om specifieke metaalionen in oplossingen aan te tonen [3, 4]. De bij deze analysemethode gebruikte reagentia blijken ook ge bruikt te kunnen worden om de oppervlakken van vaste deeltjes selectief te kleuren. Roest vast staal oppervlakken worden echter door een zeer bestendig chroomoxidelaagje be schermd [5], wat verwijderd moet worden voordat chemische gekleuring kan plaatsvinden. Bij dit onderzoek is dat bereikt door de deeltjes handmatig te schuren. Bij industriële toepassingen kan bijvoorbeeld gebruikgemaakt worden van met kwartszand gevulde wastrommels. IJzer en chroom zijn de enige legeringselementen die in alle roestvaststaaltypen voorkomen. In mengsels van zware non-ferrometalen komen echter ook veel verchroomde deeltjes voor, die niet in het roestvaststaalconcentraat thuishoren. Om deze reden is in de literatuur gezocht naar stoffen die selectief met ijzer kunnen reageren en kleuren. Bij het onderzoek bleek kaliumferricyanide (een niet-giftige stof) de oppervlakken van geschuurde roestvaststaaldeeltjes zeer selectief blauw te kleuren, nádat deze deeltjes met zwavelzuur behandeld zijn. De blauwe kleur is het gevolg van het neerslaan van het blauwe precipitaat ‘Pruisisch Blauw’, dat dus onoplosbaar is in water of verdund zwavel zuur. Daarnaast wordt roestvast staal door de behandeling met zwavelzuur donkergrijs gekleurd. Deze kleuring is echter minder selectief: zink kleurt daardoor ook donkergrijs. Andere zware non-ferrometalen (zoals lood, koper en messing) veranderen door deze behandelingen niet of nauwelijks van kleur. Tijdens de behandeling van geschuurde roestvaststaaloppervlakken met zwavelzuur [1] en kaliumferricyanide [2] treden de volgende chemische reacties op:
- Fe + H2SO4 → FeSO4 + H2 [1]
- FeSO4 + K3(Fe(CN)6) → KFe(Fe(CN)6)↓(donkerblauw) +
- K2SO4 [2]

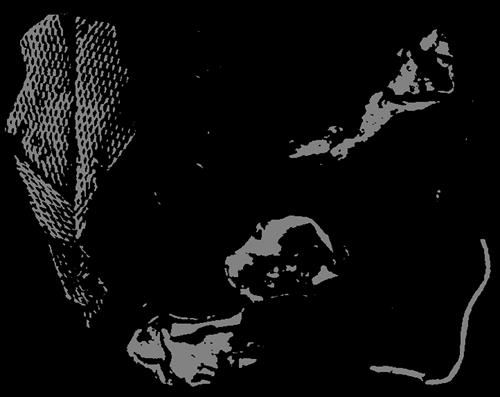
Afbeelding 2 Voorbeeld van het beeld van de deeltjesstroom: a. onbewerkt, b. na toepassing van grijswaarde (135) met een threshold-bewerking. Gedetecteerd worden hier 4 stukken roestvast staal en 1 koperdraad met gele isolatielaag; 1 stuk roestvast staal, 2 klosjes koperdraad en een stuk messing gaan op in de achtergrond.
Optimalisatie
De snelheid en de intensiteit van de kleuring hangen af van de concentraties van de gebruikte chemicaliën, de temperatuur en de behandelingsduur. Voor industriële toepassing is het van belang dat de benodigde concentraties zo laag mogelijk zijn om aantasting van de procesapparatuur te voorkomen en om de operationele kosten te beperken. Daarnaast moet de kleuring zo snel mogelijk plaatsvinden in verband met de productiesnelheid. Om de invloed van de genoemde parameters te testen, zijn kleuringsproeven uitgevoerd bij diverse zwavelzuurconcentraties, temperaturen en behandelingstijden. De resultaten zijn geëvalueerd met de eerder beschreven threshold-functie, waarbij ongekleurd roestvast staal een grijswaarde van 255 heeft. Afbeelding 3 toont een voorbeeld van de gemeten invloed van de toegepaste behandelingsduur en de zwavelzuurconcentratie bij 70ºC op de mate van kleuring. Een lagere zwavelzuurconcentratie dan 0,5 M levert bij 70ºC geen kleuring op.
Over het algemeen volstaan lagere zwavelzuurconcentraties wel bij hogere temperaturen, zoals uit de tabel blijkt. In deze tabel zijn (als voorbeeld) de laagste zwavelzuurconcentraties samengevat die bij een bepaalde temperatuur leiden tot een grijswaardeafname van 55%. Ook is duidelijk te zien dat bij hogere temperaturen de benodigde behandelingsduur ook korter wordt. Temperatuur en concentratie hebben bij een behandeling met zwavelzuur dus een duidelijk effect op de kinetiek van reactie [1]. Reactie [2] is veel minder gevoelig voor deze parameters. Al bij kamertemperatuur kan een 0,001 M kaliumferricyanideoplossing met zwavelzuur voorbewerkte roestvaststaaloppervlakken direct donkerblauw kleuren. De donkerblauwe kleur is intenser en beter verdeeld over de roestvaststaaloppervlakken wanneer de deeltjes tussen de zwavelzuur- en kaliumferricyanidebehandelingen níet worden afgespoeld met water. Bij het gebruik van geconcentreerd zwavelzuur bestaat dan echter het gevaar dat er blauwzuurgas ontstaat. Door verdunde zwavelzuuroplossingen te gebruiken wordt dit gevaar vermeden.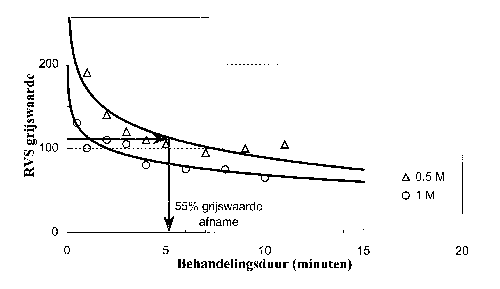
Afbeelding 3 Invloed van behandelingsduur en zwavelzuurconcentratie op de kleuring van roestvast staal bij 70ºC.
Tabel Invloed van temperatuur en zwavelzuurconcentratie op de behandeltijd die nodig is om een grijswaardeafname van 55% te krijgen.
Selectiviteit
Naast roestvast staal kleurt dus ook zink donker door de behanding met zwavelzuur. Zink kan echter eenvoudig van roestvast staal gescheiden worden door standaard eddy current-scheiding (1). De selectiviteit van de kleuring met kaliumferricyanide is hoger dan met zwavelzuur: van de zware non-ferrometalen kleuren alleen roestvast staal en deeltjes die vergroeid zijn met roestvast staal of een stukje ijzer hierdoor blauw. Afbeelding 4 illustreert de selectiviteit van beide reacties. Roestvast staal is donkerblauw gekleurd, zink donkergrijs en het plastic op het klosje koperdraad blauw door de aanwezigheid van een ijzeren insluitsel bij een van de contactpunten. De deeltjes in afbeelding 4 zijn afzonderlijk van elkaar behandeld. Wanneer de deeltjes gezamenlijk behandeld worden in bijvoorbeeld een dompelbad, treden verschillende andere chemische en elektrochemische reacties op, waardoor blauwkleuring van roestvast staal niet meer optreedt. Bovendien bestaat de kans dat andere metalen dan ook gekleurd worden. Industrieel kan dit probleem bijvoorbeeld opgelost worden door de deeltjes op een chemisch resistente lopende band met de chemicaliën te besproeien.
Toepassingen
Wanneer geschuurde zware non-ferrodeeltjes afzonderlijk van elkaar met zwavelzuur behandeld worden, kleuren roestvaststaal- en zinkdeeltjes binnen enkele minuten donkergrijs. Op basis van zwartwitbeeldanalyse, met een zwarte achtergrond en met als threshold-waarde de laagste grijswaarde waarmee gekleurde roestvaststaaldeeltjes níet gedetecteerd worden, kunnen dan door optische scheiding niet-roestvaststaal- en niet-zinkdeeltjes gedetecteerd en afgescheiden worden. Door eddy current-scheiding kunnen roestvast staal en zink vervolgens van elkaar gescheiden worden. Als er voldoende roestvast staal in de deeltjesstroom aanwezig is, kunnen de proceskosten verlaagd worden door eddy current-scheiding vóór chemische kleuring en optische scheiding uit te voeren. De kosten van eddy current-scheiding liggen per ton materiaal namelijk beduidend lager dan die van optische scheiding. Een tweede nieuwe mogelijkheid voor optische scheiding op basis van zwartwitbeeldanalyse die de kleuring van roestvast staal met zwavelzuur biedt, is scheiding op basis van een bepaald grijswaarde verschil. In dit geval worden deeltjes roestvast staal en zink gedetecteerd en afgescheiden. Alle deeltjes moeten dan echter zowel vóór als ná chemische kleuring door een beeldanalyseopstelling verwerkt worden, wat hogere proceskosten per ton materiaal als gevolg heeft. Tenslotte kan, na selectieve blauwkleuring van roestvaststaaldeeltjes door behandeling met zwavelzuur en kalium ferricyanide, optische scheiding op basis van kleuren beeldanalyse tot een goed roestvaststaalconcentraat leiden. Omdat er bij dit onderzoek geen optische scheidingsinstallatie op basis van kleuren beeldanalyse beschikbaar was, kon dit echter niet getest worden.
Vóór chemische behandeling.
Ná chemische behandeling.
Afbeelding 4 Kleuring van verschillende zware non-ferrometalen door behandeling met zwavelzuur (71/2 minuut met 0,5 M bij 70ºC) en kaliumferricyanide (1 minuut met 0,1 M bij kamertemperatuur).
Conclusies
De hier gepresenteerde chemische kleuringsmethoden bieden nieuwe mogelijkheden om de optische scheiding van roestvast staal uit mengsels van zware non-ferrometalen te verbeteren. Voor industriële toepassing van deze methode zijn er echter nog verdere studies nodig, met name naar het kostengunstig verwijderen van het chroomoxidelaagje van roestvaststaaloppervlakken en de veiligheids- en kostenaspecten van de toepassing van chemicaliën in de scheiding.
Literatuur
1. Rendorp, J.P. (1999). Automatisering van roestvaststaalscheiding: selectieve chemisch geïnduceerde kleuring. Afstudeerverslag TU Delft, Faculteit der Technische Aardwetenschappen, Sectie Grondstoffenverwerking, Mijnbouwstraat 120, Delft.
2. Nijkerk, A.A. & Dalmijn, W.L. (1998). Handbook of recycling techniques. pp. 196-198. Nijkerk Consultancy, Den Haag.
3. Vogel, A.I. (1954). A text-book of macro and semi macro qualitative inorganic analysis. 4th edition. pp. 2-203, 260-298. Longmans, Green and co, London.
4. Feigl, F. (1960). Spot tests in inorganic analysis (vertaling door Oesper, R.E.). 6th edition. pp. 1-70, 263- 281. Elsevier, Amsterdam.
5. Tomashov, N.D. (1966). Theory of corrosion and protection of metals, The science of corrosion. pp. 32, 44, 351, 356-358, 441, 523-596. The Machmillan Company, New York.



