Het corrosieverloop van thermisch verzinkte deklagen in de atmosfeer
De oxidelaag op staal is poreus; vocht en zuurstof dringen hier gemakkelijk doorheen en tasten het staal aan, waarbij volumineuze corrosieprodukten gevormd worden. Wanneer geen maatregelen worden genomen, gaat 1 dit proces gestaag door.
ing. F. Sjoukes - (artikel gepubliceerd in Roestvast Staal nummer 1, 1989- artikel 117)
Een zeer dunne zinklaag op het staal is reeds voldoende het staal langdurig tegen atmosferische corrosie te beschermen. Op het zinkoppervlak wordt een dunne laag zinkzouten gevormd, die het zink afschermt en de corrosie zeer vertraagt. Voorwaarde is dat de zuurgraad van het regenwater niet te laag is (lit.1 ). Het corrosieverloop van een thermisch verzinkte deklaag verschilt van zinklagen die op andere wijzen zijn aangebracht, omdat de thermisch verzinkte laag is opgebouwd uit zink-ijzerlegeringslagen afgedekt met een laag zink, terwijl andere zinklagen geen ijzer bevatten. Om het verloop van de corrosie van thermisch verzinkte deklagen te kunnen verklaren, is het nodig eerst in het kort de opbouw van deze lagen te beschrijven.
De opbouw van een thermisch verzinkte laag
De laag bestaat uit drie zink-ijzerlegeringslagen met, vanaf het staaloppervlak gerekend, een afnemend ijzergehalte. De legeringslagen zijn gewoonlijk afgedekt door een laag gestold zink, die meestal zuivere zinklaag wordt genoemd (afb. 1). Daar ze evenwel niet meer dan 98,5% zink bevat, de rest is hoofdzakelijk lood en ijzer, wordt deze laag in deze verhandeling stollingslaag genoemd. De zink-ijzerlegeringslagen worden gevormd als zink in aanraking is met ijzer bij een temperatuur van 200°C en hoger. De vormingssnelheid is bij 200°C zeer gering, maar neemt bij stijgende temperatuur geleidelijk toe. Bij het smeltpunt van zink (419,6°C) wordt de vormingssnelheid plotseling aanzienlijk groter, zodat bij de verzinktemperatuur (450-460°C) reeds binnen een seconde de drie legeringslagen onstaan. Deze lagen groeien verder zolang ze met zink in aanraking
zijn en de temperatuur aan het grensvlak ijzer-legeringslagen hoger is dan 200°C. De groei verloopt parabolisch met de tijd indien de zêtalaag compact is. Dat betekent dat reeds na enige minuten de lagen nog maar heel langzaam dikker worden. Als de zêtalaag niet compact is, maar een losse structuur heeft, verloopt de groei van de legeringslagen ongeveer lineair met de tijd. De legeringslagen blijven met grote snelheden doorgroeien, waarbij een legeringslaag wordt gevormd die bijna geheel uit zêtakristallen is opgebouwd. De legeringslagen blijven doorgroeien zolang ze in aanraking zijn met zink (ook nadat het voorwerp het zinkbad heeft verlaten), totdat de temperatuur aan het grensvlak lager dan 200°C is geworden. Hierbij kan de stollingslaag geheel of gedeeltelijk omgezet worden in zêtakristallen. In het eerste geval reiken deze kristallen tot aan het oppervlak, hetgeen de oorzaak is van het doffe uiterlijk van sommige zinklagen . Dit verschijnsel doet zich hoofdzakeiijk voor bij staal met een siliciumgehalte hoger dan 0,20% (afb.2).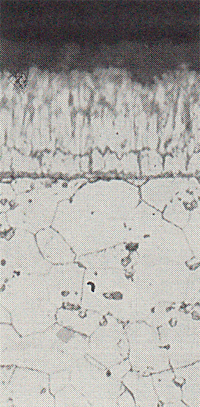
Afbeelding 1. Opbouw van een zinklaag door thermisch verzinken aangebracht.
Afbeelding 2. Lichtmasten gemaakt van verschillende soorten staal. Het staal van het dikke gedeelte bevat teveel silicium. De zêtakristallen zijn doorgegroeid, waardoor de zinklaag mat is geworden.
Gedurende de groei van de legeringslagen wordt de laag met een hoger ijzergehalte (delta) omgezet in een laag met een lager gehalte (zêta), dat van de drie lagen het geringste ijzergehalte heeft (lit.2). Tijdens deze omzetting komt ijzer vrij, dat zich rond de kristallen afzet. Als er geen stollingslaag aanwezig is bevindt dit ijzer zich aan het zinkoppervlak. In een vochtige omgeving oxideert het ijzer spoedig en vormt bruine oxidatieproducten. Het vloeibare zink in het zinkbad is, behalve met ongeveer 1,2% lood, ook verzadigd met 0,03% ijzer (lit.3). Door afkoeling raakt het zink met beide metalen oververzadigd. Het lood speelt bij de corrosie van zink geen rol. Het zink uit de stollingslaag raakt niet alleen door afkoeling oververzadigd met ijzer, er is ook nog een andere oorzaak. Als het voorwerp het zinkbad heeft verlaten wordt het zink uit de stollingslaag geheel of gedeeltelijk verbruikt voor de groei van de legeringslagen, totdat de temperatuur aan het grensvlak lager dan 200°C is geworden. Het ijzer neemt niet deel aan de vorming en blijft over. In iedere zinklaag, door thermisch verzinken aangebracht, bevindt zich dus vrij ijzer, hetgeen de oorzaak is van het bruinverkleuren van deze lagen in een vochtige omgeving (lit.4). Deze verkleuring wordt alleen waargenomen op zinklagen die legeringslagen bevatten, dus op thermische en gesherardiseerde zinklagen (lit.5).
Het verloop van de corrosie
Een inspectie van zinklagen wordt gewoonlijk uitgevoerd door het min of meer regelmatig verrichten van diktemetingen en door de vaststelling in hoeverre de zinklaag is bruin verkleurd . Laagdiktemetingen moeten altijd op dezelfde plaats worden uitgevoerd omdat de zinklaag niet overal even dik is (lit.6). De corrosie van de zinklaag kan worden gevolgd aan de hand van dwarsdoorsneden van de laag door ze met een metaalmicroscoop te bestuderen. Het is vaak moeilijk om van grote voorwerpen, balken en hoeklijnen dwarsdoorsneden te maken. In plaats daarvan kunnen kleine en bij voorkeur dunne voorwerpen, b.v. dun verzinkt plaatwerk, worden gebruikt waarvan het corrosieverloop hetzelfde is als van grote voorwerpen.
De reacties van zink met vochtige lucht
Op het moment dat het voorwerp uit het zinkbad wordt getrokken reageert het nog vloeibare zink, dat over de legeringslaag naar beneden stroomt, onmiddellijk met zuurstof uit de lucht. Hierdoor ontstaat op het zink een dunne, bijna onzichtbare oxidelaag. In vochtige lucht wordt de oxidelaag omgezet in een dubbelzout, bestaande uit zinkcarbonaat en zinkhydroxide (ZnCO3 , 3Zn(OH)2) dat een dichte, goed hechtende, in neutraal water oplosbare en beschermende laag op het zinkoppervlak vormt. Het is deze laag die het zink beschermt tegen inwerking van de atmosfeer. Wordt de zinklaag door een of andere oorzaak beschadigd, dan vormt zich op het vrijgekomen zink direct een beschermende laag van gelijke samenstelling als de oorspronkelijke laag. Op deze wijze wordt het zink zeer langdurig tegen de inwerking van de atmosfeer beschermd (lit.7).
Deze beschermende laag kan slechts ontstaan wanneer het oorspronkelijk gevormde zinkoxide in aanraking komt met koolzuur en vocht uit de lucht. Wanneer geen of slechts weinig koolzuur aanwezig is, b.v. bij aanràking met condenswater waarin zich heel weinig koolzuur bevindt, dan wordt een laag gevormd die hoofdzakelijk bestaat uit Zn(OH)2. Dit hydroxide is wit en volumineus en vormt het grootste deel van de zgn. witte roest. Het is daarom zeer belangrijk om pas verzinkte voorwerpen zodanig op te slaan dat zich eerst de beschermende laag kan vormen voordat ze aan weer en wind worden blootgesteld, èn ervoor te zorgen dat zich op de verse zinklaag geen condenswater kan vormen. Als de beschermende laag niet is gevormd, wordt het zink sterk door de atmosfeer aangetast. Wanneer een niet te zware witte roestlaag later in aanraking komt met voldoende koolzuur uit de lucht, wordt alsnog een beschermende laag gevormd. Een geringe vorming van witte roest is dus niet schadelijk voor de corrosieweerstand van het zink (lit.B).
Het verloop van de corrosie in een landelijke atmosfeer
Een nieuwe zinklaag ziet er mooi glimmend uit, hoewel ze reeds bedekt is met een dunne oxidehuid. In de lucht wordt de laag spoedig mat, ten teken dat de beschermende laag zich heeft gevormd. Op den duur wordt het zinkoppervlak blauwgrijs en soms wordt reeds een begin van bruinverkleurig zichtbaar (afb.3). Deze verkleuring breidt zich in de loop der jaren langzaam en onregelmatig over het zinkoppervlak uit. Men kan dit verschijnsel duidelijk waarnemen op verzinkte vangrails die langs autowegen zijn gemontee1d. Pas als het bru ine oppervlak ruw aanvoelt is het onderliggende staal aangetast. Het verloop van de corrosie kan aan de hand van dwarsdoorsneden van zinklagen worden vastgesteld. De microfoto's voor deze verhandeling zijn gemaakt van een deksel van een thermisch verzinkt vuilnisvat, dat meer dan 50 jaar in een landelijke atmosfeer heeft gestaan (afb.4). Op een microfoto van een pas verzinkte laag is de stollingslaag helder. Door verwering wordt deze laag eerst wit, om na vele jaren langzaam bruin te verkleuren. Deze bruinverkleuring kan alleen veroorzaakt zijn door het vrije ijzer dat in de zinklaag aanwezig is. In de volgende fase van de verwering wordt de zêtalaag aangetast. Zêtakristallen corroderen praktisch niet, ze worden als het ware plaatselijk uit de legeringslaag gebroken en zijn in de verweerde stollingslaag terug te vinden (afb.5).
Daarna corrodeert op dezelfde plaats eerst de delta-en dan de gammalaag. De corrosie van deze kristallen verloopt nog langzamer dan die van de zêtakristallen. Nadat de gammakristallen zijn verdwenen wordt het ijzer van het onderliggende staal aangetast. Er ontstaan bruine volumineuze corrosieproducten die door hun grotere volume uit de zinklaag steken en een kleine verhoging vormen. Rond zulk een verhoging zijn de legeringslagen nog aanwezig (links en rechts in afb.6). Zolang een roestplek op het zink niet ruw aanvoelt is het onderliggende staal niet aangetast. Door de kathodische werking van de legeringslagen rond zulke verhogingen worden deze slechts langzaam groter. Het duurt daarom nog lang, voordat ze tot een echte roestplek zijn samengegroeid. Dankzij de beschermende laag op het zinkoppervlak wordt de zinklaag zelf praktisch niet dunner. In de zinklaag vinden echter veranderingen plaats die uiteindelijk tot de vernietiging van de laag voeren. De corrosie op vlakke delen van balken enz. verloopt zoals boven beschreven. Aan de randen van verzinkte profielen treedt een eigenaardig verschijnsel op.
Ofschoon de zinklaag op hoeken dikker is dan op vlakke delen, verkleurt en corrodeert de zinklaag daar eerder dan op vlakke delen (afb.7). De verklaring hiervoor is als volgt: Het volume van zêtakristallen is groter dan dat van ijzer. In een normale zinklaag (links in afb.8) staan de zêtakristallen onder druk. Hun groei wordt geremd en er ontstaat een compacte legeringslaag. Op hoeken staan de zêtakristallen niet onder druk en hebben ze dus ruimte om snel door te groeien. Er ontstaat een niet compacte doch dikke zêtalaag en daardoor een dunne deltalaag (rechts in afb.8). Door atmosferische corrosie zal het vrije ijzer dat zich om de zêtakristallen bevindt hier eerder verkleuren dan op vlakke delen. De verkleuring van de zinklaag en later de corrosie van het onderliggende ijzer begint daarom eerst aan de kanten van verzinkte profielen en verbreidt zich langzaam over het vlakke deel van de zinklaag. Op de hoeklijn van afb.9, die meer dan 60 jaar geleden is verzinkt en al die tijd buiten heeft gestaan, is het verloop van de corrosie duidelijk te zien. De kanten zijn ruw, hier is het onderliggende ijzer gecorrodeerd. Na al deze jaren is de zinklaag in het midden van het vlakke gedeelte echter nog bijna geheel intact. Zinklagen gevormd op siliciumhoudend staal zijn soms mat van kleur (afb.2).
Op zulk staal groeien de zêtakristallen zeer snel, ook nadat het voorwerp het zinkbad heeft verlaten. De groei houdt aan totdat of het zink uit de stollingslaag geheel is verbruikt of nadat de temperatuur aan het grensvlak staal-legeringslaag beneden de 200°C is gedaald. Als de stollingslaag ontbreekt liggen de zêtakristallen aan het zinkoppervlak en dus ook het vrije ijzer dat deze kristallen omgeeft. In de vochtige lucht corrodeert dit ijzer snel en kleurt het zinkoppervlak bruin. Dit is de reden waarom matte zinklagen al na enige dagen bruin kunnen worden (afb.10). Zêtakristallen waaruit zulk een laag bestaat zijn beter corrosiebestendig dan zink. Daar komt bij dat deze lagen dikker zijn dan normaal (150 tot soms 500 mikron), terwijl de zêtakristallen geen neiging hebben uit de laag te breken. Om deze redenen heeft zulk een zinklaag een zeer lange levensduur. De bruine kleur verdwijnt echter niet meer. Galvanisch aangebrachte zinklagen bestaan uit zuiver zink. Daar ze geen ijzer bevatten verkleuren deze niet wanneer ze corroderen. Er wordt geen overgangslaag gevormd zodat glimmend zink en gecorrodeerd staal naast elkaar aanwezig zijn (afb.11 ).
Afbeelding 3. Op zinklagen waar de zinkbloemen nog aanwezig zijn kan al een begin van bruinverkleuring optreden.
Afbeelding 4. Corrosie van de zinklaag van een deksel van een thermisch verzinkt vuilnisvat dat langer dan 50 jaar in een landelijke omgeving heeft gestaan.
Afbeelding 5. Microfoto van een dwarsdoorsnede van een zinklaag, waarvan de stollingslaag door corrosie is verkleurd en waarin losse, niet gecorrodeerde zêtakristallen aanwezig zijn.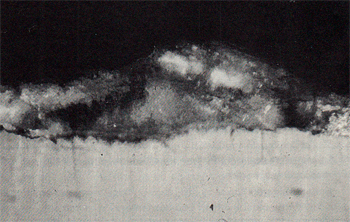
Afbeelding 6. Dwarsdoorsnede op een plaats waar het staal van het deksel is aangetast. Rondom de aangetaste plek zijn nu nog legeringslagen aanwezig.
Afbeelding 7. Door corrosie verkleurde zinklaag op een kant van een hoeklijn.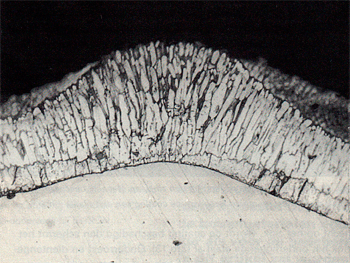
Afbeelding 8. Microfoto van een zinklaag. Op het vlakke deel van het proefplaatje is de zêtalaag compact, op de hoek zijn deze kristallen doorgegroeid omdat ze niet onder druk staan.
Afbeelding 9. Thermisch verzinkte hoeklijn, die langer dan zestig jaar in een landelijke omgeving heeft gestaan. De corrosie verbreidt zich van de kanten naar het midden uit.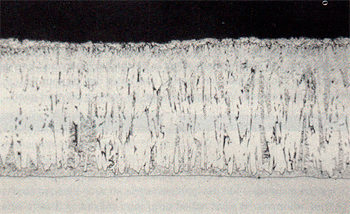
Afbeelding 10. Microfoto van een thermisch verzinkte laag ontstaan op staal met een siliciumgehalte van 0,33%. Na een korte expositie buiten is het zinkoppervlak reeds bruin verkleurd.
Afbeelding 11. Door corrosie verkleurt een galvanisch aangebrachte zinklaag niet. Er wordt geen overgangslaag gevormd zodat zink naast gecorrodeerd ijzer aanwezig is.
Het verloop van de corrosie in een industriële en maritieme atmosfeer
Een industriële atmosfeer wordt in feite gekenmerkt door de lage zuurgraad (pH) van het regenwater. Het verloop van de zinkcorrosie hangt in hoofdzaak af van deze zuurgraad. Als de pH hoger is dan 5.5 is de beschermende laag stabiel en de corrosie van het zink zeer traag (afb.12). Is de zuurgraad lager, dan worden eerst de beschermende laag, daarna het zink en vervolgens de legeringslagen door het regenwater opgelost. Hoe snel dit gebeurt hangt niet alleen af van de pH van het regenwater, maar ook van de tijd dat de zinklaag vochtig is, want een droge zinklaag corrodeert niet (lit.9). Het is daarom van te voren niet aan te geven hoe lang de levensduur van een bepaalde zinklaag in een industriële atmosfeer zal zijn. Er zijn vele onderzoeken verricht aangaande de corrosie van zink in een maritieme omgeving; er is echter weinig gepubliceerd over het verband tussen de corrosiesnelheid van zink en de hoeveelheid zeezouten in de atmosfeer (lit. 0). In het algemeen geldt dat de corrosie sterker is naarmate de zoutconcentratie in de lucht hoger is en het zinkoppervlak langer vochtig blijft.
Oppervlakken blijven in een maritieme atmosfeer lang vochtig door het zeer hygroscopische magnesiumchloride dat deel uitmaakt van het zeezout. Uit de praktijk is gebleken dat de corrosiesnelheid van zink in een maritieme omgeving tussen die van een industriële en landelijke omgeving in ligt. Zoals gezegd wordt zink in een droge atmosfeer niet aangetast en de levensduur in een droge omgeving is onbegrensd. Men moet er natuurlijk wel voor zorgen dat er zich geen condenswater op het zinkoppervlak kan vormen. Condenswater is zeer aggresief voor zink, dat hierin gemakkelijk oplost onder vorming van witte volumineuze zinkhydroxiden. Als de beschermende laag in een bepaalde atmosfeer niet gevormd kan worden of niet kan bestaan, moet de zinklaag afgedekt worden met een coating die de functie van de beschermende laag overneemt. Door het synergistisch effect is de corrosieweerstand van de combinatie van zink met een coating veel beter dan de som van beide lagen tesamen. Voorwaarde is dat de coating blijvend goed hecht op het zink. Wordt de coating beschad igd dan schermt het zink het onderliggende staal af (afb.13) . Onderroest en dientengevolge afbladderen van de verflaag kan niet plaats vinden.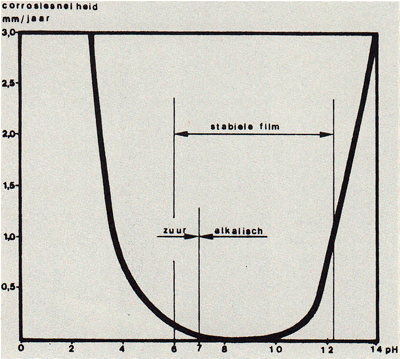
Afbeelding 12. Het verband tussen de corrosiesnelheid van zink en de pH van water.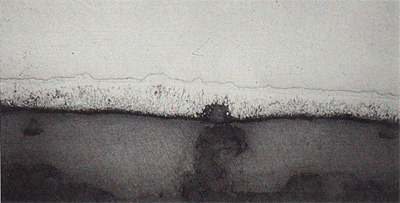
Afbeelding 13. Een beschadigde coating op een zinklaag. Het zink beschermt het staal; onderroest en afbladderen van de coating kan niet plaats vinden.
Literatuur
1. Roetheli, B.E. e.a; Metals and Alloys 3, P.73-76 (1932)
2. Horstmann. D; Proc.14th lnt.Conf. on Hot Dip Galv. München 1985
3. Trusdale, E.C. e.a.; Techn.Pub. 65 1-E, Oct.1935, Am.lnst.Mining Metall Engrs.3
4. Sjoukes F.; Finish. lnd. Vol.2 No.4 Apr.1978 P.26-29
5. Sjoukes F.; Metall.41 Jrg Heft 3, März 1987, 5268-270
6. Sjoukes,F.; Electropl. and Metal Finish ., Nov. 1974, 5.17-21
7. Gibert,P.T. & Hadden,S.E .; J .inst.Met., P.47-70,78 (1). sept. 1950
8. Bablik,H.; Sheet Metal lnd., P.845-846. 31 (330) Oct.1954
9. Schikor,G. ; Werst.u.Korrosion 15, P.537-543 (1964)
10. Slunder,C.J . & Boyd ,W .K.; Zinc : lts corrosion resistence. I.L.Z.R.D.,New Vork



