Het bijzondere van water (4) - Colloïdale systemen
Colloïdale systemen spelen een grote rol in de natuur. Het is zeker geen laboratoriumfenomeen. Een zeer alledaags voorbeeld, met soms zeer ingrijpende maatschappelijke gevolgen, is mist. Colloïdale systemen worden ook in de techniek toegepast. Een voorbeeld daarvan is de verfindustrie, waar op grote schaal van dit verschijnsel gebruik wordt gemaakt. In deze aflevering van de serie over water meer hierover.
Artikel gepubliceerd in Corrosie nummer 5 1990.
Colloïdale oplossingen in water
Disperse stelsels
Wanneer een stof als suiker in water oplost, verdelen zich de moleculen van de suiker tussen de moleculen van het water tot een homogeen mengsel. Men noemt dit een ware oplossing. Schudden van een weinig fijnverdeeld krijt met water, geeft een witte, melkachtige vloeistof, maar men noemt dit geen oplossing. Men heeft te doen met korreltjes krijt, ieder nog bestaande uit vele miljoenen moleculen, te midden van de watermoleculen. Dit is geen homogeen, maar een heterogeen mengsel van een vaste stof in een vloeistof. Denkt men zich deze korreltjes kleiner en kleiner, zodat zij in de vloeistof blijven zweven, dan nadert het mengsel meer en meer de toestand van een ware oplossing. Al dergelijke toestanden, heterogene mengsels van kleine deeltjes van een stofte midden van een andere stof, noemt men disperse stelsels. Deze worden verdeeld in z.g. grof-disperse (diameter der deeltjes groter dan 0,1 micron; 1 micron= 0,001 mm) en fijndisperse of colloïde stelsels (diameter kleiner dan 0,1 micron). Hoewel de eigenschappen van de verschillende disperse stelsels zeer geleidelijk veranderen met afnemende grootte der deeltjes en ten slotte continu overgaan in de eigenschappen van ware oplossingen, is de genoemde grens toch niet willekeurig. Deeltjes met een diameter van 0,1 micron en kleiner zijn met een gewone microscoop niet meer zichtbaar. Bovendien houdt bij deze grens ook de mogelijkheid van filtratie met een gewoon papierfilter op. Deeltjes met een grotere diameter dan 0,1 micron worden door goed filtreerpapier wel tegengehouden, kleinere deeltjes lopen met de vloeistof mee door het papierfilter heen. In de afbeeldingen 1 en 2 is een overzicht gegeven van de afmetingen van deeltjes en filterporiën. Bij de filters wordt de grens tussen colloïdaal en grof gelegd bij een poriënwijdte van 0,45 of 0,50 p.m.
Verschillende soorten disperse stelsels Disperse stelsels bestaande uit een fijnverdeelde vaste stof zwevend in een vloeistof worden suspensies genoemd. Bestaat het disperse stelsel uit twee vloeistoffen die zich niet mengen en waarvan de ene in de vorm van uiterst fijne druppeltjes verdeeld is te midden van de andere, dan spreekt men van een emulsie. Maar ook andere combinaties van aggregaatstoestanden kunnen een dergelijk dispers stelsel vormen. In het schema in afbeelding 3 vindt men acht verschillende mogelijkheden. 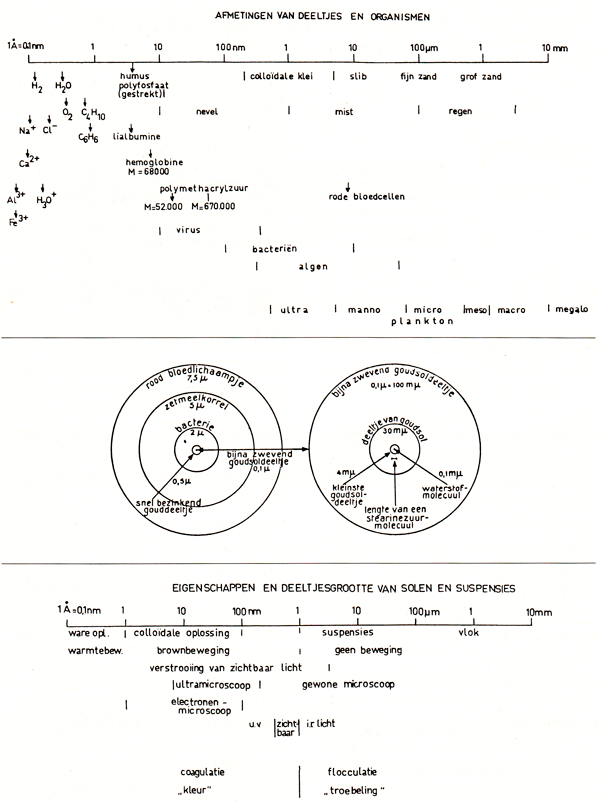
Afb. 1. Afmetingen van deeltjes en organismen.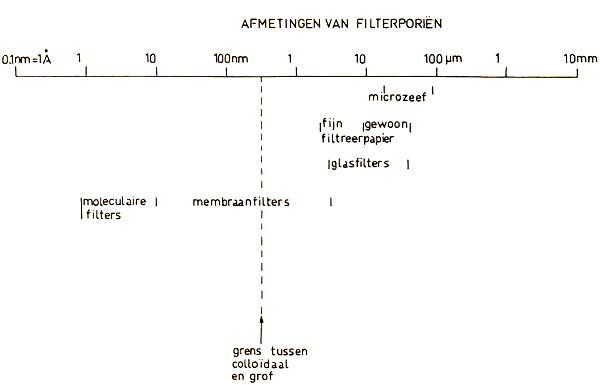
Afb. 2. Afmetingen van filterporiën.
Afb. 3. Diverse combinaties van aggregatietoestanden, die een dispers stelsel geven.
Colloïdale oplossingen
Bereiding van gelen en solen
Een colloïdale oplossing of sol van macromoleculen kan bereid worden door oplossing van de macromoleculen in een geschikt oplosmiddel op precies dezelfde wijze als bij een stof met moleculen van normale afmetingen. De oplossing is stabiel, in thermodynamisch evenwicht en kan 1015 tot 1018 deeltjes per ml bevatten. (Een 1 molaire oplossing van suiker telt 6 x 1020 deeltjes per mi). Het proces is omkeerbaar of reversibel, het oplosmiddel kan voorzichtig verdampt worden en daarna is het mogelijk de macromoleculen opnieuw in oplossing te brengen. Deze solen worden ook wel lyofiel (vloeistof lievend) of hydrofiel (water lievend) genoemd. Colloïdale oplossingen van klompjes moleculen of atomen kunnen op twee wijzen verkregen worden. Zulke hydrofiele colloïden worden ook wel gelen genoemd.
A. Kleine deeltjes laat men groeien, tot zij colloïdale afmetingen verkregen hebben. Deze condensatie gebeurt bijv. als een ware oplossing van zwavel in een met water mengbaar organisch oplosmiddel wordt uitgegoten in water. Er ontstaat een sterke oververzadiging, waardoor veel kristalkiemen worden gevormd, die niet meer voldoende zwavel in de vloeistof aantreffen om uit te groeien tot grote deeltjes: het blijft een colloïdale oplossing. Zo'n zwavelsol, waarvan de deeltjes ongeveer even groot zijn (monodispers). kan maximaal 108 deeltjes per ml bevatten. Anderzijds kunnen ook colloïdale oplossingen worden verkregen wanneer de oplossingen zo verdund zijn, dat om deze reden grote agglomeraten niet kunnen worden ge.vormd.
B. Grote deeltjes worden verdeeld in vele kleinere. Dit gebeurt bij de verffabricage. Deze dispersie kan plaatsvinden in een colloïdmolen. Dit is een trommel, die gedeeltelijk is gevuld met kogels van hard materiaal, waarin de vaste stof wordt fijngemalen. Het fijne poeder wordt dan in andere machines met het dispersiemiddel verwreven. Een andere methode is door het overslaan van vonken onder water tussen twee metaalstiften teneinde deze metalen te verstuiven. Hierbij ontstaan metaalsolen als het metaal platina, goud of zilver is en metaaloxidesolen in geval van de minder edele metalen. Tenslotte bestaat de mogelijkheid een vers geprecipiteerde stof bijv. een sulfide te overgieten met water. Het zal blijken dat in dit laatste geval het wegnemen van een te veel aan ionen de voorwaarden schept voor het colloïdaal in oplossing gaan. Solen, waarvan de deeltjes bestaan uit een verzameling van moleculen, atomen of ionen zijn thermodynamisch niet stabiel. Men noemt deze irreversibel, lyofoob (vloeistof mijdend) of hydrofoob (water mijdend). Bij het bewaren worden de deeltjes langzamerhand groter, de sol 'veroudert' en tenslotte zijn de gevormde deeltjes zo groot, dat zij bezinken. Er vormen zich kristalletjes, die niet meer op eenvoudige wijze in een colloïdale verdeling terug te voeren zijn. Zowel bij de solen van macromoleculen als bij de irreversibele solen zullen in het algemeen de deeltjes niet van dezelfde grootte zijn, het sol is heterodispers. Homodisperse solen ontstaan alleen bij bijzondere omstandigheden of kunnen met behulp van een ultracentrifuge afgescheiden worden.
Filtreren en bezinken bij solen
Een colloïdale oplossing kan bevrijd worden van grovere deeltjes door filtratie met behulp van een filter met poriën van 0,45 of 0,50 μm. Meestal neemt men hiervoor een membraanfilter, gemaakt van cellulose-acetaat of een dergelijk materiaal. Vorming van een filterkoek zal zo veel mogelijk vermeden moeten worden, daar dan ook kleinere deeltjes het filter niet kunnen passeren. De scheiding van gewone moleculen of ionen vindt plaats door dialyse. De sol wordt gebracht in een zak of een slang, die aan de uiteinden is afgesloten (zie afbeelding 4). De zak of slang is gemaakt van een plantaardig of dierlijk membraan (bijv. perkament) of tegenwoordig meest van kunststof (collodion, cellofaan enz.) en bezit zulke fijne poriën (bijv. 10 nm) dat de moleculen en ionen wel worden doorgelaten, maar de colloïdale deeltjes niet. De zak of slang wordt nu ondergedompeld in het zuivere oplosmiddel, dat geregeld wordt ververst. Een dergelijk dialyseproces duurt dagen of weken. De tijdsduur hangt af van de snelheid, waarmee het oplosmiddel wordt ververst en de mate van zuiverheid, die wordt verlangd. Bij de niet-stabiele solen mogen de ionen niet volledig verwijderd worden, daar de sol dan niet meer bestendig is en spontaan coaguleert. Zo'n membraan met fijne poriën kan ook dienen om de colloïdale deeltjes te scheiden van de vloeistof. In analogie van de filtratie heet dit proces ultrafiltratie. Het gaat veellangzamer dan een gewone filtratie. Om de snelheid zo veel mogelijk op te voeren wordt een vacuüm aangebracht onder het ultrafilter en overdruk er boven. Het verkregen ultrafiltraat bevat dezelfde concentratie aan moleculen en ionen als de vloeistoftussen de colloïdale deeltjes en kan dienen om de oorspronkelijke sol te verdunnen zonder dat nevenverschijnselen optreden. De deeltjes van een grove suspensie bezinken op den duur. Voor een kleine bezinkingssnelheid geldt de wet van Stokes. De sedimentatiesnelheid van colloïdale deeltjes is zo gering, dat kleine verschillen in temperatuur, trillingen, enz. in de jaren die daarvoor nodig zijn, elke meting onmogelijk maken. Bovendien is er nog een ander verschijnsel dat de sedimentatie beïnvloedt. Colloïdale deeltjes zijn zo klein dat de warmtebeweging van de moleculen van het oplosmiddel botsingen uit verschillende richtingen tussen moleculen en het deeltje oplevert, die elkaar niet geheel compenseren. Het deeltje gaat in vertraagd tempo deelnemen aan de warmtebeweging en wel des te sneller naarmate het kleiner is. Dit wordt brownbeweging genoemd naar de Schotse botanicus Brown, die deze beweging het eerst waarnam bij in water gesuspendeerde stuifmeelkorrels (1827). Hierbij geldt, dat de gemiddelde kinetische energieën van deeltjes en moleculen gelijk zijn. Het verschijnsel kan worden waargenomen met een ultramicroscoop. Dit is een toestel waarmee veel kleinere deeltjes kunnen worden waargenomen dan met een gewone microscoop. De grens van de waarneembaarheid van afzonderlijke deeltjes ligt bij een gewone microscoop bij ongeveer 0,1 micron. Bij kleinere deeltjes buigen de lichtgolven om de deeltjes heen. Bij de ultramicroscoop, zie afbeelding 5, worden de deeltjes door een zeer sterke, convergerende lichtbundel belicht. Het punt waar de lichtstralen samenkomen wordt waargenomen met een microscoop, die loodrecht staat opgesteld op de richting van de lichtbundel. Door terugkaatsing en verstrooiing van het zeer sterke licht gaan de colloïde deeltjes optreden als zelfstandige lichtpuntjes. Omdat er geen ander licht door de microscoop valt, is dus een aantallichtvlekjes te zien tegen een zwarte achtergrond. Sedimentatie en brownbeweging samen zullen een distributie van de deeltjes bij een homodispers sol geven, die overeenkomt met die van de moleculen in de atmosfeer: in de bovenlaag weinig deeltjes, dicht bij de bodem veel deeltjes. Dit is inderdaad bij deeltjes van ongeveer 0,5 μm onder de microscoop waargenomen. De deeltjes van een grove suspensie kunnen ook van de vloeistof worden gescheiden door centrifugering. Op deze wijze kan de normale sedimentatie of bezinking vele malen versneld worden, daar de centrifugale kracht veel groter is dan de zwaartekracht. Bij een centrifuge wordt naast het aantal toeren per minuut dat bereikt kan worden, de centrifugale versnelling in het midden van de vloeistofkolom opgegeven, uitgedrukt in aantal malen g, de versnelling van de zwaartekracht. Zo heeft een grote laboratoriumcentrifuge bij 5000 omwentelingen per min. een versnelling van ongeveer 4500 g. Voor het afscheiden van colloïdale deeltjes is een ultracentrifuge nodig, een centrifuge die een veel groter aantal omwentelingen kan maken bijv. 60.000 omw/min. en waarbij de versnelling van de grootte-orde van 300.000 g is. Meestal loopt een ultracentrifuge op een luchtkussen. Het is een ideale methode om een colloïd te isoleren. Vooral in de polymeerchemie en de biochemie (en daar vooral bij de bestudering van eiwitten) wordt het apparaat veel gebruikt.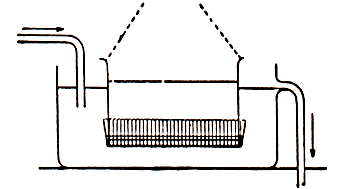
Afb. 4. Schematische dialyse opstelling.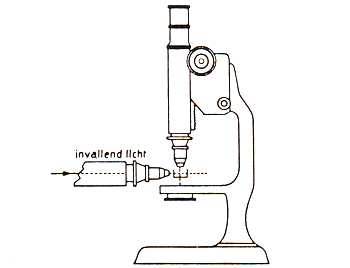
Afb. 5. Schematische weergave ultramicroscoop.
Stabiliteit van solen
Deeltjes, die onder normale omstandigheden snel groeien tot ze zo groot zijn geworden, dat ze neerslaan, blijven in geval van een colloïdaal systeem beneden die neerslaggrens. Bij de stabiliteit van solen spelen ionen en dus elektrische ladingen een grote rol. De stabiliserende faktor is de lading die de deeltjes bij hun ontstaan krijgen. Daardoor stoten de deeltjes elkaar af en kunnen ze niet verder groeien. De lading bestaat uit positieve of negatieve ionen, die uit de oplossing aan het oppervlak worden geadsorbeerd. Omdat de oplossing als geheel neutraal blijft, bevindt zich in het dispersiemiddel rondom het geladen deeltje een laag van tegengesteld geladen ionen, zie afbeelding 6. 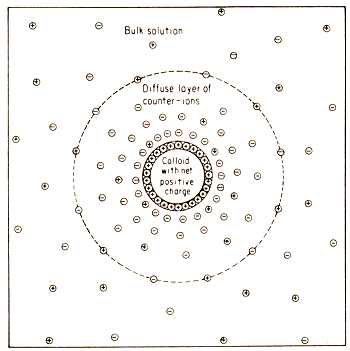
Afb. 6. Een, in dit geval, positief geladen colloidaal deeltje met rondom een diffuse ionenlaag van tegenovergestelde lading.
Elektroforese bij solen
Bij een thermodynamisch niet stabiele sol speelt het elektrolytgehalte een grote rol. De sol kan ontstaan als een vers gevormd neerslag wordt gewassen met gedestilleerd water, dus als een klaarblijkelijk te veel aan elektrolyten wordt verwijderd en de sol wordt onbestendig, wanneer de laatste ionen door dialyse zijn verdwenen. Omgekeerd kan door toevoeging van elektrolyt een dergelijke sol tot coagulatie worden gebracht.
Het blijkt dat de colloïdale deeltjes van irreversibele solen altijd en van reversibele solen meestal een elektrische lading, hetzij positief, hetzij negatief bezitten. Dit kan men aantonen door op een sol in een u-vormige buis (afbeelding 7) voorzichtig ultrafiltraat (of een vloeistof van ongeveer gelijke samenstelling) in beide benen te brengen en door middel van twee platinaelektroden een spanningsverschil van ongeveer 100V aan te leggen. De scheidingsvlakken tussen sol en ultrafiltraat verplaatsen zich dan bij positief geladen deeltjes in de richting van de negatieve pool en omgekeerd. De elektroforese kan ook waargenomen worden als men de colloïdale oplossing in de poriën van een gel (een colloïdale verdeling die het water zo sterk gebonden houdt dat een gelei ontstaat) of van filtreerpapier brengt. De methode wordt ook wel toegepast om colloïden uit water te isoleren.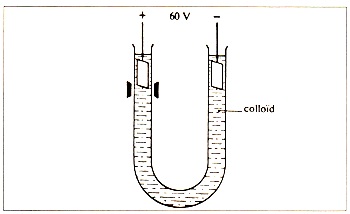
Afb. 7. Opstelling voor elektroforese van een colloid.
Tenslotte kan men de elektroforese ook onder een (ultra)microscoop bestuderen aan de beweging van individuele deeltjes, tenminste als de brownbeweging langzaam is. Door de kleine brekingsindex zijn eiwitten e.d. moeilijk zichtbaar, maar kleine glas-of kwartsdeeltjes bedekt met eiwit door onderdompeling in de sol gedragen zich als het eiwitdeeltje zelf. De lading van een sol blijkt afhankelijk te zijn van de omstandigheden. Zo is een zilverchloridesol negatief, wanneer er overmaat chloride aanwezig is en positief bij overmaat zilverion. Tegenover de overmaat aan negatieve resp. positieve ionen, die aan het colloïdale deeltjes gehecht zijn staat een overmaat van tegengesteld geladen ionen in de vloeistof. Aanvankelijk meende men dat deze positieve en negatieve laag als een rij van ionparen bij elkaar lagen: dubbellaag van Gouy (1910), hoewel de ionen, die zich het dichtst bij de laag met tegengestelde lading bevinden, een bijzondere positie innemen. Bij de beweging van het geladen deeltje onder invloed van een elektrisch veld is er een deel van de diffuse laag met tegengestelde lading in de vloeistof, dat met het deeltje meegaat. De overige ionen bevinden zich in de vloeistof en zullen onder invloed van het elektrisch veld juist in tegengestelde richting gaan bewegen. De potentiaal van het scheidingsvlak tussen deeltjes en niet mee bewegende vloeistof is bepalend voor de snelheid, waarmee het deeltje gaat bewegen. Er is overigens gevonden, dat het vrijwel onmogelijk is om solen te maken zonder dat er kleine hoeveelheden elektrolyt aanwezig zijn. Wordt getracht om uit een sol alle elektrolyt door middel van dialyse te verwijderen, dan volgt meestal uitvlokken van het sol. Uitvlokken is het opheffen van de colloïdale toestand. Dit kan plaatsvinden door het wegnemen van de lading van soldeeltjes door ionen. Het zal duidelijk zijn, dat bij positieve solen de negatieve ionen van het toegevoegde elektrolyt het werk doen en vice versa. De lading van de ionen speelt een grote rol. Als er bijvoorbeeld een bepaalde hoeveelheid chloride ionen nodig is om een sol te doen uitvlokken, dan is die hoeveelheid voor sulfaat ionen (SO4 2-) minder en voorfosfaat ionen (PO4 3-) nog weer minder.
Stabiliteit van gelen
Ook de thermodynamisch stabiele solen en gelen hebben meestal een lading. Zo heeft een eiwit macromolecuul in een tamelijk zuur milieu een positieve lading door de aanwezigheid van aan het koolstofskelet verbonden ammoniumgroep (NH3 +)met daar tegenover een overschot van negatieve ladingen in de vloeistof. In een basisch milieu is de lading negatief, doordat dan de carboxylgroepen (COOH) een lading dragen (COO-) en de ammoniumgroepen overgegaan zijn in aminogroepen (NH2 ) zonder lading. Daar tussen in, meestal in de buurt van pH 5 of 6, ligt het iso-elektrische punt, waar niet de lading nul is, maar positieve en negatieve ladingen elkaar juist compenseren. De colloïdale eiwitoplossing is daar toch stabiel, de aanwezige ladingen zorgen voor een mantel van gerichte watermoleculen, die belet dat de eiwitmoleculen bij botsing zich verenigen tot een groter complex onder invloed van de Vanderwaalskrachten. Wel is de mogelijkheid van agglomeratie bij de pH van het iso-elektrische punt het grootst. Vermindering van lading is nodig, maar niet voldoende voor samenklontering (coagulatie). Bij andere macromoleculen is meestal ook een lading aanwezig. Zo bestaat zetmeel niet alleen uit zuivere glucoseresten, maar er komen ook carbonzuur-of fosforzuurgroepen voor, die de zetmeeloplossing een negatieve lading kunnen geven. Wanneer de carbonzuurgroepen ongesplitst zijn, kunnen zij toch water binden. Het waterstofatoom van de carbonzuurgroep vormt dan een brug tussen de zuurstofatomen van zuur en water, de zogenaamde waterstofbinding en er ontstaat weer een mantel van gerichte watermoleculen. Er is bij reversibele solen een specifieke werking van hydronium-en hydroxylionen. Zij geven aanleiding tot het vormen of verdwijnen van groepen met een lading. Een ander onderscheid met de irreversibele solen is dat de grenslaag bij een bepaalde pH een vrijwel constant aantalladingen bevat. Deze macromoleculen duidt men aan als poly-elektrolyten. De reversibele solen kunnen tot coagulatie worden gebracht door de mantel van gerichte watermoleculen weg te nemen. Dit kan plaatsvinden door toevoeging van een zeer geconcentreerde elektrolytoplossing, bijvoorbeeld natriumchloride. De ionen oefenen een sterkere kracht uit op de watermoleculen dan het soldeeltje; dit verliest zijn gerichte watermoleculen en bij botsing kan nu agglomeratie van de deeltjes plaatsvinden. De concentratie van elektrolyt nodig voor dit uitzouten is het geringst bij het iso-elektrische punt. Ook organische vloeistoffen die met water mengbaar zijn zoals ethanol, binden water door middel van de waterstofbinding, de grote hoeveelheid alcoholmoleculen 'ontmantelt' het soldeeltje en de sol coaguleert.
De vorm van de deeltjes bij reversibele solen
Op een enkele uitzondering na zijn de deeltjes van irreversibele solen bij benadering bolvormig. De macromoleculen van een reversibel sol hebben dikwijls een ketenvormige structuur. Dit wil nog niet zeggen dat de soldeeltjes dan staafvormig zijn, want de schakels van de keten zijn ten opzichte van elkaar beweegbaar en er is een bijzondere soort brownbeweging van de delen van het molecuul ten opzichte van elkaar. De Vanderwaalskrachten zijn ook werkzaam tussen de verschillende delen van een ketenvormig molecuul. Het resultaat van brownbeweging en Vanderwaalskrachten is, dat de meest stabiele vorm van zo'n macromolecuul een kluwen of een sterk gespiraliseerd geheel is.
Het kan ook zijn dat de omstandigheden tijdens het ontstaan van het macromolecuul zodanig waren, dat de keten gestrekt is. Worden de ketenvormige delen dan door vertakkingen of bruggen van bijzondere aard vastgelegd dan ontstaat een star staafvormig macromolecuul zoals bijvoorbeeld bij cellulose en zetmeel. Bij kluwenvormige synthetische macromoleculen wordt wel waargenomen dat het molecuul zich strekt, wanneer het milieu zo verandert dat er ladingen ontstaan. Zo is polyacrylzuur kluwenvormig maar polyacrylaat gestrekt. Een draad van dit materiaal, die beurtelings overgoten wordt met zuur en base zal respectievelijk krimpen en rekken. Door de aantrekkende Vanderwaalskrachten en de afstotende coulombkrachten kan een gewicht op en neer bewogen worden. Dit is een chemische motor, waarin direct chemische energie in arbeid wordt omgezet.
Staafvormige macromoleculen hebben soms maar in één dimensie colloïdale afmetingen. Ketenvormige moleculen met een betrekkelijk klein molecuulgewicht zijn in gestrekte toestand veellanger dan 1 nm en vormen zodoende een overgang naar colloïdale deeltjes. Een polyfosfaation P20 O61 -22 is ongeveer 4,0 nm lang, het vertakte dodecylbenzeensulfonaation is in gestrekte toestand in een grensvlak 1 nm lang en stearinezuur C17H35COOH onder dezelfde voorwaarden 2,6 nm bij een doorsnede van 2 nm2.



