Blog Ko Buijs: Wetenswaardigheden over metaal
Een metaal is een scheikundig element uit een van de volgende reeksen in het periodiek systeem van de elementen t.w. alkalimetalen, aardalkalimetalen en overgangsmetalen. Kenmerken van een metaal zijn goede mechanische eigenschappen, glanzend, taai en veelal een hoog smeltpunt. Bovendien hebben metalen een hoog vermogen om warmte en elektriciteit te geleiden. De atomen van een metaal vormen een speciale chemische binding waarbij de valentie-elektronen in elkaars banen komen. Zo ontstaat er een elektronenwolk waardoor per definitie een sterke metaalbinding ontstaat. Over bovenstaande feiten wordt later in deze blog wat meer in detail bij stilgestaan.
Door Ko Buijs - Innomet Consultancy BV
Metalen worden meestal gevonden in de natuur en gedolven in de vorm van erts of een mineraal. Een erts of mineraal bestaat uit het te winnen metaal dat gebonden is aan andere elementen. Meestal is dat het element zuurstof. Door reductie of elektrolyse wordt het metaal met energie, chemisch vrijgemaakt van deze verbinding. Een goed voorbeeld is wat er gebeurt in een hoogoven waar ruw ijzer wordt gemaakt vanuit ijzererts.
- Dit betreft de reductieformule: 2FeO + C + energie ➙ 2Fe + CO2
- Echter ijzer wil daarna weer graag terug naar een stabiele en natuurlijke situatie. Dat kan droog chemisch verlopen volgens de oxidatieformule: Fe + O2 ➙ 2FeO + energie
- of nat chemisch volgens de formule 2Fe + 2H2O + O2 ➙ 2Fe(OH)2 + e.
Dit wordt ook wel roesten genoemd maar beter is het om het woord corroderen te gebruiken. Oppervlaktetechnieken worden dan toegepast om dit corroderen te voorkomen. Metalen hebben fysische en thermische eigenschappen en hierbij kan gedacht worden aan atoomgewicht, atoomvolume, kristalstructuur, dichtheid, smeltpunt, kookpunt, soortelijke warmte, latente smeltwarmte, uitzettingscoëfficiënt, elektrische weerstand en warmtegeleidingsvermogen. Daarnaast bezitten metalen mechanische eigenschappen zoals treksterkte, rekgrens, rek, insnoering, hardheid en de elasticiteitsmodules. Mechanische waarden zijn sterk afhankelijk van de structuur m.u.v. de elasticiteitsmodules.
Daarnaast zijn er overige eigenschappen en daarbij kan gedacht worden aan de magnetische, optische en nucleaire eigenschappen alsmede de corrosiebestendigheid. Metalen zijn ook te legeren met andere metalen. Een legering is een mengsel van twee of meerdere metalen, dat meestal ontstaat in de gesmolten toestand. Legeringen worden geproduceerd om aan metalen de gewenste eigenschappen te verschaffen; zoals sterkte, hardheid, taaiheid, corrosiebestendigheid, lasbaarheid. Soms kan een legering ook wel niet-metalen bevatten zoals koolstof en stikstof. Voorbeelden van legeringen zijn koper met tin dat brons wordt genoemd en messing dat een legering is van koper met zink. IJzer met voldoende chroom en nikkel levert roestvast staal op. Metalen zoals aluminium, nikkel, lood, koper en titaan worden non-ferrometalen genoemd terwijl koolstofstaal en roestvast staal onder de ferrometalen vallen. Hoe edeler een metaal wordt, hoe moeilijker het chemisch reageert. Metalen die niet reageren met zuurstof en water worden edel genoemd. Voorbeelden zijn goud, platina, zilver, antimoon e.d. Onedele metalen zijn aluminium, ijzer, zink, nikkel, lood, cadmium, mangaan, chroom, tin, titaan, magnesium, natrium, kalium e.d. Er zijn grote verschillen in reactiviteit waardoor het ene onedele metaal veel sneller corrodeert dan het andere.
Alkalimetalen
Alkalimetalen zijn zeer onedele metalen omdat deze een hoge reactiviteit hebben met zuurstof. De alkalimetalen zijn lithium, kalium, natrium, rubidium, cesium en francium. In de buitenste elektronenschil heeft het atoom slechts een elektron. Het zijn prima reductie-elementen die zelfs onder een beschermde substantie bewaard moeten worden om geen spontane reactie met de omgeving aan te gaan. Dergelijke metalen reageren ook heftig met halogenen waardoor er zouten ontstaan. Alkalimetalen hebben een zeer goede thermische en elektrisch geleidingsvermogen. In het periodiek systeem staan deze alkalimetalen vermeld in blok I (zie afbeelding 1).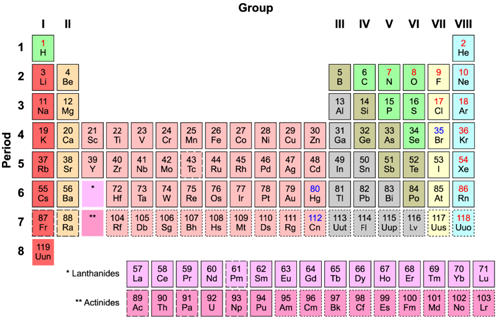
Afbeelding 1. Periodiek systeem (bron Armtuk, licentie CC BY-SA 3.0 via Wikimedia Commons).
Aardalkalimetalen
De aardalkalimetalen zijn de elementen in de groep II van het periodiek systeem (afbeelding 1). Het betreffen slechts 6 elementen t.w. beryllium, magnesium, calcium, strontium, barium en radium. Deze metalen bezitten veel eigenschappen die gewone metalen ook bezitten. Uiterlijk gezien zijn deze glanzend en witachtig maar door oxidatie worden de oppervlakken al vrij snel dof. Aardalkalimetalen hebben twee elektronen in de buitenste schil die niet sterk gebonden zijn aan de atoomkern. Daarom zijn deze metalen zeer reactief maar niet zo sterk als alkalimetalen. De smeltpunten zijn relatief laag en de vervormbaarheid is goed omdat deze metalen vrij zacht en sterk zijn. Aardalkalimetalen reageren met halogenen. Dat betreffen de zoutvormende elementen jodium, chloor, fluor en broom waardoor er halogeniden ontstaan.
Overgangsmetalen c.q. metalen
Overgangsmetalen vormen tezamen het middelste grote blok van het periodiek systeem (afbeelding 1). De elementen met dezelfde hoeveelheid valentie-elektronen staan onder elkaar in een groep. De elementen in zo’n groep, hebben veel gemeenschappelijk met elkaar en dat vooral met het oog op de corrosiebestendigheid. Alle metalen in het middelste blok zijn goed te vervormen en te verspanen alsmede goed lasbaar. Metalen bestaan bij de gratie van een metaalbinding. In de buitenste elektronenschil van het metaalatoom bevindt zich een elektron die een zwakke binding heeft met de kern. Dat komt door de aanwezige elektronen die zich in diverse schillen tussen dit valentie-elektron en de kern bevinden. Dat bewerkt a.h.w. een afscherming tussen dit elektron en de kern. Bovendien zal de relatief grote afstand tussen dit elektron en de kern deze binding nog zwakker maken. Dat betekent dat deze elektronen zich vrij door het atoomrooster kunnen bewegen waardoor deze als een soort cement de atomen bij elkaar houden. M.a.w. de negatief geladen vrije elektronen binden de positieve metaalionen aan elkaar vast. Dat is in het kort de uitleg over de metaalbinding. Doordat deze valentie-elektronen zich vrij door het rooster kunnen verplaatsen is dat tevens de verklaring waarom een metaal elektrische stroom kan geleiden.
